 |
Кислотность и основность органических соединений.
|
|
|
|
Для описания кислотных и основных свойств химических соединений существует несколько теорий – теория Бренстеда, теория Льюиса и ряда других. Наиболее распространенной является Бренстеда, или протонная теория.
· По теории Бренстеда кислотой называют вещество, способное отдавать протон, а основанием – вещество, способное связывать (принимать) протон.
Из этого следует, что теоретически любое соединение, в состав которого входит атом водорода, может его отдавать в виде протона и, следовательно, проявлять свойства кислоты. Способность отдавать протон могут проявлять не только нейтральные молекулы, но заряженные частицы – катионы или анионы. Это хорошо видно на простых известных примерах неорганических веществ и ионов – хлороводород HCL, катион аммония NH4+, гидросульфат – ион HSO4- и т. д.
В роли оснований могут выступать анионы - частицы, несущие отрицательный заряд, например хлорид- ион Сl-, гидроксид-ион НО-, гидросуфат- ион HSO4- и др. Основаниями могут быть и нейтральные молекулы в состав которых входит гетероатом (обычно атом азота, кислорода или серы), имеющий неподеленную пару электронов, например этанол C2H5OH, этантиол C2H5SН и т. д.
Нейтральные молекулы или заряженные частицы, которые способны в зависимости от условий проявлять как свойства кислот, так и оснований, называют амфотерными.
Кислоты и основания проявляют свои свойства только в присутствии друг друга. Ни одно вещество не будет отдавать протон, т. е. проявлять кислотные свойства, если в системе нет акцептора протона – основания. И, наоборот, ни одно вещество не может проявить свойства основания, т.е. принять протон, если в системе нет источника протонов – кислоты.
|
|
|
Кислота, отдавая протон, превращается в сопряженное основание, а основание, приняв протон, превращается в сопряженную кислоту. Кислоту обычно обозначают АН (от анг. Acid-кислота), а основание- В (от англ.- base основание).
Взаимодействие кислоты и основания можно в общем виде представить уравнением(1).

К - константа равновесия Ка – константа кислотности
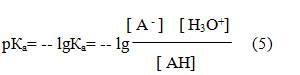
Отрицательный десятичный логарифм
Чем меньше величина рКа, тем сильнее кислота.
Основность вещества обычно оценивают по величине рКа сопряженной кислоты. Чтобы показать, что оценивается сила основания, используют обозначение рКвн+. Чем больше величина рКвн+ сопряженной кислоты, тем сильнее основание.
Органические соединения с позиций кислотности и основности описываются общими теориями, в частности теорией Бренстеда. В тоже время органические соединения, как кислоты и основания, обладают многими специфическими качествами. Одним из них является существенное изменение кислотности или основности в гомологическом ряду. Для органических соединений одного класс нельзя сделать однозначное утверждение, что все представители этого класс являются, например, сильными кислотами. Можно говорить лишь о возможности проявления кислотных свойств, например, соединениями класса спиртов. Действительно, если первые представители гомологического ряда спиртов проявляют заметные кислотные свойства, то при переходе к высшим гомологам эти свойства постепенно ослабевают.
Другой особенностью является то, что в силу неисчислимо большого количества органических соединений, невозможно иметь для каждого из них количественную оценку кислотных и основных свойств. Поэтому в органической химии часто используется путь сравнительного сопоставления свойств одного соединения с другим, для которого такие количественные характеристики известны.
|
|
|
Кислоты.
В органических соединениях атом водорода может связан с такими элементами, как сера, кислород, азот и углерод. Элемент и связанный с ним атом водорода называют центром кислотности. По центрам кислотности органические соединения подразделяются на SH-, OH-, NH-, CH- кислоты (таблица). Как правило, органические соединения проявляют слабые кислотные свойства. Это означает, что они не взаимодействуют с водой как с основанием по приведённому выше уравнению(2).
Исключение составляют карбоновые кислоты, диссоциирующие в воде на протон и анион кислоты.
СН3СООН + Н2О ↔ СН3СОО - + Н3О+
Уксусная кислота ацетат- ион
|
|
|


