 |
Сопряжение – это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной.
|
|
|
|
Сопряжение возникает в результате образования единого
p–делокализованного облака, принадлежащего более чем двум атомам.
Чтобы появлялся мезомерный эффект, молекула должна иметь p–связь, а заместитель вступал в сопряжение с ней.
Эффект сопряжения, в отличии от индуктивного эффекта, он передаётся по сопряжённой системе без затухания.
+ М -эффектом наблюдается, если заместитель подаёт электроны в цепь сопряжения.Обладают группировки.юимеющие неподелённые пары электронов,особенно отрицательный заряд. Способность заместителя предоставить свою неподелённую пару электронов в сопряжение тем выше, чем меньше электроотрицательность,по этому в изоэлектронном ряду(ряду,состоящем из частиц, имеющим одинаковое кол во электронов) убывает слева направо: -NR2>-OR>-F
- М -эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. - М -эффект характерен для групп -CH=O, -COOH, -NO2. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Наблюдается, если заместительоттягивает на себя электроны. Он характерен для заместителей, имеющих кратные связи
Закономерности проявления
1 –мэф тем сильнее,чем больше электроотрицательностьимеющихся в заместителе атома CH=CHR<-CH=NR<C=O
2 –мэф растёт с увеличением заряда заместителя-О-<-SH-
Вопрос2
Альдегиды и кетоны относят к карбонильным соединениям, так называю органические вещества,в молекулах которых имеется группа >C=O(карбонил,оксигруппа)
|
|
|
Общая формала карбонильных соединений R-CX=O
В зависимоти от типа заместителя Х эти соединения подразделяют на
1 альдегиды(X=H, R=H или углеводородный заместитель)
2 кетоны (X, R углеводородные радикалы)
Альдегиды-органические соединения,в молекулах которыхатом углерода карбонильной группы связан с атомом водорода
R-COH общая формула
R=H алкил, арил
-CH=O альдегидная группа
Кетоны органические вещества,молекулы которых содержат карбонильную группу,соединённую с 2 углеводородными радикалами
Общие формулы R2C=O, R-CO-R’
R.R’ =алкил арил
Строение
Двойная свзя C=O сильно полярная и одновременно поляризуемая, т к образована из 2 атомов с сильно различающимися электоротрицательность
Атом углерода находится в SP2-гибридизации, двойная связь С=О состоит из гамма и пи связей. Карбонильные соединения обладают слабыми электродонорными свойствами(сравнимы с алканолами и простыми эфирами) Одновременно они проявляют электроакцепторные свойства
RR”C=O+e- à[RR’C=O]-
В результате присоединения электрона образуется анион-радикал,неспаренный электрон локализуется на низшей свободной молекулярной орбитали,которая является разрыхляющей. Поэтому уменьшается порядок пи связи в анион-радикале, и часто такой анион радикал изображается как частица с сильно поляризаванным неспаренным электроном
Высокополярная альдегидная группа в альдегидах и кетонах оказывает существенное влияние на связи, примыкающие к ней.. Связи С –Н у альдегидов и кетонов менее прочны по сравнению с С -Н и по аналогии с алкенами реакции замещения по той связи у альдегидов и кетонов должны идти явно легче
Реакции приводящие к образованию:
1 окисление алкенов. Алкены под действием сильных окислителей расщепляются по двойной связи с образованием 2 кетонов
RR1C=CR2Hà[o] R1RC=O+O=CR2H
2 окисление спиртов RCH2OHà[o] R-COH
|
|
|
3 гидолиз геминальных(содержащих атомы галогена приодном атомеС)углеводородов
RR1CF2àh2o RR1C(OH)2=RR1C=O+H2O
4 гидратация алкинов RC---CR1+водаàкат. HRC=COHRàRCH2COR1
5 прямой синтез Реакция алкенов с CO и H2 в присутствии тетракарбонилгидрида кобальта при повышенной температуре и давлении
6 пирролиз кальциевых солей (RCOO)2CaàRCOR+CaCO3
 7 реакция Фриделя-Крафтса
7 реакция Фриделя-Крафтса
AlCl3 H+ Pt O2 h2so4
Бензол+H3C-CH-CH2à бензольное кольцо-СH(CH)3 CH3àбензольное кольцо-СOOH(CH)3CH3àфенол+СН2-СO-CH3
8гидратация ацетиленовый углеводородов

Вопрос 3
Моносахаоиды это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов. Моносахариды можно рассматривать как производные многоатомных спиртов, содержащих карбонильную группу(альдегидную или кетонную)если карбонильная группа находится в начале цепи, то моносахарид являющийся альднгидоспиртом,называется альдозой. При любом другом положении этой группы моносахарид называется кетозойю По количеству углеводородных атомов в молекуле различают триозы, тетрозы и т д… наиболее распространены в природе пентозы и гексозы
Общая формула CnH2nOn.
Классификация моносахаридов:
1.По количеству атомов C монозы делятся на:
триозы – 3 C, тетрозы – 4C, пентозы, гексозы, гептозы
 2.По характеру функциональных групп:
2.По характеру функциональных групп:
 а) альдозы () - полиоксиальдегиды (нр глюкоза)
а) альдозы () - полиоксиальдегиды (нр глюкоза)
глицериновый альдегид
 |
б) кетозы () - полиоксикетоны (нр фруктоза)

диоксиацетон
1реакции алкилирования Алкилирующими агентами в реакциях образования простых эфиров по всем ОН группам моносахаридам служат более реакционноспособные,чем спирты,галогенпроизводные алканов
В зависимости от алкилирующего агента и условий реакции получаются различные продукты реакций. Метанол в присутствии сухого HCl метилирует только полуацетальный или полукетальный гидроксил.Алкилирование других гидроксильных групп удаётся осуществить только под действием сильных алкилирующих агентов(тиосульфат щёлочи)
2ацилирование Моносахариды легко ацилируются с образованием сложных эфиров в присутствии избытка уксусного ангидрида в присутствиикислотных или основных катализаторов
Вопрос 4
. Напишите формулу карбонильного соединения, которое обесцвечивает бромную воду (в присутствии железа), нитруется и восстанавливает серебро из аммиачного раствора серебра.
|
|
|
Билет 53
Вопрос1
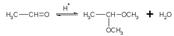
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами.
П рисоединение воды и алканолов происходит только к очень активным карбонильным соединениям(формальдегиду, галогензамещённым альдегидам и кетонам). Для других веществ требуется активация карбонильной группы путём кислотного катализа
 в реакции с алканолами получаютсяполуацетали. В случае избытка алканола полуацетали превращаются в ацетали
в реакции с алканолами получаютсяполуацетали. В случае избытка алканола полуацетали превращаются в ацетали
 Образование ацеталей из полуацеталей подобно реакции получения простых эфиров при межмолекулярной дегидратации спиртов
Образование ацеталей из полуацеталей подобно реакции получения простых эфиров при межмолекулярной дегидратации спиртов
Частицы действуют как доноры электронной пары по отношению к положительному заряженному атому углерода и называются нуклеофильными реагентами(нуклеофилами)
Реакции образования полуацеталей и ацеталей обратимы, по этому ацетали и полуацетали легко гидрализуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы
Реакцию получения ацеталей широко используют в органических синтезах для "защиты" активной альдегидной группы от нежелательных реакций:
Вопрос 2
Карбоциклические соединения изоциклические соединения, органические соединения, содержащие в молекулах кольца (циклы) из атомов углерода. Карбоциклические соединения отличаются от гетероциклических соединений, циклы которых содержат, кроме атомов углерода, атомы др. элементов, чаще всего О, N или S, а также от ациклических соединений, не содержащих циклов. Карбоциклические соединения — один из основных классов органических соединений, который подразделяют на алициклические соединения и ароматические соединения (бензоидного и небензоидного характера). Карбоциклические соединения чрезвычайно распространены; многие из них имеют большое практическое значение. Так, к ним относится значительная часть углеводородов нефти, терпенов, ряд антибиотиков, многие красители, лекарственные вещества, инсектициды и др.; их применяют для получения синтетических смол, пластических масс и т.д.
|
|
|
Циклоалканы

 Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:

 Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:
Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:
Циклопропан и его производные присоединяют галогены и галогеноводороды:
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
Реакция галогенирования циклогексана идёт по радикальному механизму
Введение нитрогруппы
Циклогексан+ HONO2à нитрохлоргексан+вода
Вопрос 3
Омыляемые липиды могут быть двухкомпонентные(простые) или состоять из трёх или более компонентов(сложные) т е образовывать при гидролизе органические соединения соответственно 2, 3 и более классов
Омыляемые эфиры:
1 простые(воска, жиры, масла)
2 сложные(фосфолипиды,сфинголипиды)
Омыляемые липиды способны к щелочному гидролизу с образованием солей высших карбоновых кислот. Впервые выделенные из жиров.ю эти кислоты были названы жирными.
Биологически важные ЖК-это, кА правило,монокарбоновые кислоты с неразветвлённой углеродной цепью и чётным числом атомов углерода. Они могут быть насыщенные и ненасыщенные, последние имеют одну или несколько двойных связей, имеющих цис конфигурацию. Число атомов углерода в природных кислотах колеблется от 4 до22, но чаще встречаются кислоты с 16 или 18 атомами углерода. Наиболее распространены
C15H31COOH пальмитиновая
С17H35COOH стеариновая
2 ненасыщенные
C17H33COOH олеиновая
C17H31COOH линолевая
C17H29COOH линоленовая
Насыщенные и ненасыщенные жк различаются по своей конфигурации. В насыщенных углеводородная часть молекул может существовать в виде бесконечного числа конформаций благодаря тому, что каждая связь углеводородного скелета молекулы имеет полную свободу вращения. ЖК непредельного характера в углеводородной цепи имеют жесткий изгиб из-за отсутствия вращения вокруг двойной связи. В природных жк,имеющихцис конфигурацию относительно двойных связей, угол изгиба составляет 30 градусов, кроме того изомеры менее устойчивы, чем транс изомеры. Эти структурные особенностиненасыщенных жк имеют важное значение, особенно для мембран,представляющих собой фосфолипидные бислои, обладающие текучестью. Латеральная подвижность компонентов компонентов мембран отличает раковые клетки с высокой латеральной подвижностью от нормальных, где мембранное движение находится под контролем
|
|
|
Триаглицерин-нейтральный жир. Липиды группы триаглицеринов-депо энергии. Их энергетическая ценность примерно в 2 раза больше. чем у белков или углеводов
Основные роли жк в организме:
1с точки зрения образования АТФ-окисление жк составляет основной энергетический резерв организма;
 2 предшественники важнейших биологически активных соединений, в частности простагладионов
2 предшественники важнейших биологически активных соединений, в частности простагладионов
Вопрос 4
валин (α амино изовалериановая кислота)
1. Аминокислоты с неполярными гидрофобными радикальными группами
Т к число амино групп равно числу уарбоксильных групп, то среда при растворении является нейтральной
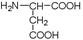
аспарагиновая кислота (асп)
(α-амино янтарная)
1. R группы заряжены отрицательно
Т к число групп COOH больше NH2 групп,то среда кислая

- лизин (лиз)
(α, e диаминокапроновая кислота)
|
|
|


