 |
Радикалы могут испытывать стерические взаимодействия и экранировать группу от действия реагентов, понижая активность альдегидов и кетонов.
|
|
|
|
Реакция дисмутации (Канницарро-Тищенко)
Альдегиды, не имеющие a углеродных атомов вступают в реакцию дисмутации – (самоокисления – самовосстановления) – реакция Канницарро – Тищенко

Реакции окисления слабыми окислителями
При окислении слабыми окислителями в щелочных средах: аммиакатом серебра, гидроксидом меди (II) альдегиды окисляются в карбоновые кислоты, при этом происходит восстановление окислителя.

Особенности непредельных альдегидов
Непредельные альдегиды – бифункциональные соединения. Они проявляют свойства альдегидов и непредельных углеводородов.
пропеналь, акриловый альдегид.
 Карбонильная группа имеет – М эффект
Карбонильная группа имеет – М эффект
Реакции присоединения по радикалу протекают против правила Марковникова.

Вопрос 3
Аминокислоты –гетерофункциональные соединения, содержащие аминную (NH2) и карбоксильную (СООН) группы. В зависимости от положения аминогруппы в углеродной цепи различают α, β, γ, δ и другие аминокислоты.
Биологический интерес представляют α-аминокислоты, которые являются структурными единицами белков. Эволюция отобрала 20 α- аминокислот для построения белков. α –аминокислоты соединяясь в различных вариациях, образуют белки, обладающие разными свойствами и биологической активностью
Общая формула α-аминокислот: 
Современная классификация α-аминокислот
1. Аминокислоты с неполярными гидрофобными радикальными группами
2. Аминокислоты с полярными незаряженными радикальными группами
3. Аминокислоты заряженные положительно
4. Аминокислоты с отрицательно заряженными радикальными группами
Кислотно-основные свойства
Проявлением этих свойств является образование заряда в кислых и щелочных средах.
|
|
|
Заряды формируются в процессе гидролиза солей:



Со свежеприготовленным гидроксидом меди (II) все α-аминокислоты
Образуют в мягких условиях внутрикомплексные соли (хелаты) синего цвета.
Свойства СООН группы
Реакция декарбоксилирования протекает очень легко, так как α углеродный атом содержит 2 электроно-акцепторные группы (NH2; -CООН).
Реакция декарбоксилирования приводит к получению биогенных аминов.
Гистидин гистамин
Триптофан триптамин
Серин коламин

Образование хлорангидридов, амидов, сложных эфиров.
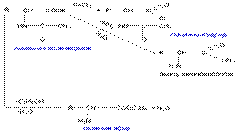
Свойства α-аминогруппы
Реакция с нингидрином, реакция на α-аминокислоты (используется для визуального распознавания α-аминокислот)
Реакция с 2.4-динитрофторбензолом (ДНФБ) – используется для отщепления N-концевой аминокислоты (щелочная среда): образуется комплекс желтого цвета.

Реакция с азотистой кислотой используется для количественного определения NH2 групп по объему выделившегося N2

Реакция карбоксилирования –NH2 приводит к получению двухосновной аминокислоты.

Практическое значение имеет реакция формольного титрования, используемая для количественного определения α-аминокислот. 
Вопрос 4
 4. Имеются α-, β-, γ-аминопроизводные масляной кислоты. Какими химическими реакциями их можно различить? Назовите продукты реакций.
4. Имеются α-, β-, γ-аминопроизводные масляной кислоты. Какими химическими реакциями их можно различить? Назовите продукты реакций.
Билет 58
ДЕГИДРАТАЦИЯ, отщепление воды от молекул орг. или неорг. соединений. Осуществляется термически (обычно в присут. катализаторов) или под. действием в-в, связывающих воду (т. н. дегидратирующих агентов, напр. Р2О5, H2SO4). Различают внутри- и межмолекулярную дегидратацию. Пример внутримол. дегидратации спиртов-синтез этилена из этилового спирта, протекающий в присут. Аl2О3 или под действием H2SO4, напр.:

Дегидратация 1,4-бутандиола в присут. солей фосфорной к-ты одна из стадий синтеза бутадиена (см. Реппе реакции):

Если строение спирта таково, что возможно два направления дегидратации, то отщепление воды осуществляется в соответствии с Зайцева правилом. Так, при дегидратации 2-пентанола почти исключительно образуется 2-пентен:

Внутримол. дегидратация спиртов часто сопровождается перемещением двойной связи или перегруппировкой углеродного скелета молекулы, напр.:

Эти процессы отсутствуют при дегидратации спиртов путем термич. разложения их сложных эфиров или ксантогенатов, напр., и Чугаева реакции:

Подобная р-ция с успехом используется в химии терпенов и стероидов. Внутримол. дегидратация карбоновых к-т приводит к образованию кетонов, дегидратация амидов к-т - к нитрилам, напр.:

Важное значение для получения гетероциклич. соед. имеет внутримол. циклодегидратация. Напр., при действии конц. H2SO4 a-ациламинокетоны превращаются в оксазолы:

|
|
|
реакция карбоксильной группы – декарбоксилирование (солей карбоновых кислот).

Это реакция одна из наиболее важных реакций карбоновых кислот. Однако незамещённые монокарбоновые кислоты декарбоксилируются трудно. Реакция протекает легче при наличии у α углеродного атома электроакцепторной группы (NO2, CCl3, CO-R…)
поляризующей C-COOH связь этого атома с карбоксильной группой:
R-CHX-COOHà(t) R-CH2-X+CO2 X= OH, CO-R, CN
Реакция декарбоксилирования протекает очень легко, так как α углеродный атом содержит 2 электроно-акцепторные группы (NH2; -CООН).
Реакция декарбоксилирования приводит к получению биогенных аминов.
Гистидин à гистамин
Триптофан à триптамин
Серин à коламин
Реакции дезаминирования (удаление NH2 группы в виде аммиака)
 окислительноеà
окислительноеà 
Гидролитическоеà  молочная кислота
молочная кислота
OH
Внутримолекулярноеà  акриловая кислота
акриловая кислота
Восстановительноеà  пропионовая кислота
пропионовая кислота
+2H
В лабораторных условиях для дезаминирования используется азотистая кислота в кислой среде
Вопрос 2
Способы получения.
1. В природных условиях некоторые кислоты встречаются в виде сложных эфиров, из которых их можно получить путем гидролиза:
R-СО-О-R' + Н2O <-> R-СООН + R'-ОН
2. Окисление альдегидов и первичных спиртов. В качестве окислителей применяются КМnO4, K2Cr2O7, HN03:
|
|
|

3. Окисление кетонов приводит к образованию кислот с меньшим числом атомов углерода в молекуле, чем в исходном кетоне
4. Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6КМn04 + 9H2S04 -= 5С6Н5СООН + 3K2S04 + 6MnS04 + 14Н20
5. Использование реактива Гриньяра по схеме:

6. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
R-ССl3 ---NaOH--> [R-С(ОН)3] -> R-СООН + Н20
Химические свойства.
1. Диссоциация кислот. Все карбоновые кислоты, подобно неорганическим кислотам, обладают кислыми свойствами, окрашивая лакмус в красный цвет. Это обусловлено диссоциацией кислот: RCOOH <-> RCOO- + Н+
2. Образование солей. Карбоновые кислоты легко всту пают в реакции с основаниями, основными оксидами и активными металлами: 2RCOOH + Mg = (RCOO)2Mg + Н2
RCOOH + NaOH = RCOONa + H2O
2RCOOH + CaO = (RCOO)2Ca + H2O
Соли карбоновых кислот сильно гидролизованы в водном растворе как соли слабых кислот. Минеральные кислоты, как более сильные, вытесняют карбоновые кислоты из их солей: CH3COONa + НСl = СН3СООН + NaCl
Карбоновые кислоты устойчивы к действию концентрированных минеральных кислот. Исключение составляет муравьиная кислота, которая под действием концентрированной H2S04 разлагается: HCOOH ---H2SO4---> CO + H2O
 3. О бразование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот:
3. О бразование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот:

Характерным для всех этих соединений является то, что они легко гидролизуются с образованием кислоты.
4. При действии галогенов на кислоты в присутствии фосфора образуются альфа-галогенозамещенные кислоты: СН3-СН2-СООН + Вг2 -> СН3-СНВr-СООН + НВr
5. При действии восстановителей, таких как LiAlH4, кислоты восстанавливаются до первичных спиртов: R-СООН -> R-СН2ОН + Н20
6. Насыщенные кислоты с нормальной углеродной цепью окисляются трудно. Кислоты с третичным атомом углерода дают при окислении оксикислоты: (СН3)2СН-СООН -> (СН3)2С(ОН)СООН
|
|
|
В атмосфере кислорода все кислоты окисляются до СO2 и Н2O.
Муравьиная кислота НСООН - бесцветная жидкость с острым запахом. Ее получают нагреванием оксида углерода (II) с порошкообразным едким натром: NaOH + СО ---2000C, P---> HCOONa ---H2SO4---> НСООН
Муравьиная кислота отличается рядом особенностей:
а) она разлагается под действием водоотнимающих средств с образованием СО;
б) она является восстановителем и дает реакцию "серебряного зеркала":НСООН + 2[Ag(NH3)2]OH -> 2Ag + (NH4)2CO3 + 2NH3 + H2O
Кроме того, муравьиная кислота окисляется хлором: НСООН + Сl2 -> СO2 + 2НСl
Уксусная кислота СН3СООН широко распространена в природе, образуется при брожении, гниении, скисании вина, молока, а также при окислении многих органических веществ. Безводная уксусная кислота имеет температуру плавления +16,6°С, кристаллы ее прозрачны, как лед, поэтому ее назвали ледяной уксусной кислотой. В промышленности уксусную кислоту получают каталитическим окислением бутана кислородом воздуха при 200°С: С4Н10 + 5/2O2 -> 2СН3СООН + Н2O
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом, отличается стойкостью к окислителям. Среди жирных кислот особое место занимают высшие жирные кислоты - пальмитиновая СН3-(СН2)14-СООН и стеариновая СН3-(СН2)16-СООН. Большое количество высших жирных кислот получают окислением парафина. Окисление проводят при продувании воздуха через расплавленный парафин в присутствии оксидов марганца при 100°С.
Оксокислоты
Простейшим представителем альдегидокислот является глиоксиловая кислота. Она образуется при окислении этиленгликоля и выделяется из реакции в виде гидрата 
Кетонокислоты представляют наибольший интерес т.к. более устойчивы к действию окислителей и существуют в свободном виде. Кроме того, некоторые кетонокислоты являются промежуточными продуктами окисления жиров, глюкозы в тканях живого организма и поэтому представляют биологический интерес.
Простейшая кетонокислота 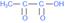
кетопропионовая или пировиноградная (ПВК)
- является центральным продуктом углеводного обмена. Жидкость с tкип=165º.
Легко получается: 1)при окислении спиртокислоты-молочной (α оксипропионовой)

|
|
|


