 |
Второе начало термодинамики (6 формулировок).
|
|
|
|
Второе начало термодинамики указывает направление протекания термодинамических процессов. Оно было установлено при анализе работы тепловой машины Карно в 1824г.
Существует более 10 формулировок второго начала, они эквивалентны:
1) Невозможен процесс единственным конечным результатом, которого является переход тепла от тела менее нагретого к более нагретому или, короче говоря, тепло самопроизвольно, т. е. без совершения работы не может переходить от холодного к горячему телу (Клаузиус)
2) Невозможен процесс единственным конечным результатом которого является превращение всей теплоты полученной от нагревателя в эквивалентную ей работу (Кельвин-плант)
3) КПД тепловой машины всегда строго меньше 1.
4) Невозможен вечный двигатель второго рода – это периодически действующий двигатель, получающий тепло от одного резервуара и полностью превращать это тепло в работу.
5) Реальные процессы в изолированной системе протекают в сторону возрастания энтропии.
6) В замкнутой системе наиболее вероятные такие процессы, когда энтропия возрастает.
Энтропия
КПД реальной тепловой машины при необрат. процессах:  =
= 
КПД обрат. процесса:  =
= 
Т.к. при необрат. процессах часть тепла теряется, то  ≤
≤ 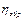
 ≤
≤ 
Или преобразовав это неравенство можно получить Неравенство Клаузиса:  ;
;  - приводимое кол-во тепла.
- приводимое кол-во тепла.
Любой круговой процесс можно представить как совокупность бесконечно малых циклов Карно
Тогда нер-во Клаузеса можно записать для i-того прцесса 
Просуммировав по всем циклам Карно: 
Пусть число разбиений на циклы Карно стремится к ∞, тогда в пределе 
Для обратимых круговых процессов имеем знак равенства  = 0
= 0
|
|
|
Известно, что если интеграл по замкнутому контуру от нек-ой функции = 0, то подынтегральное выраж-е – есть полный дифф-л нек-ой функции S, т.е.
1) 
2) Сущ. функция S состояния сис-мы, кот. подобно внутр. энергии не зависит от формы траектории и эта функция состояния сис-мы наз энтропией сис-мы.
3)Значение энтропии S для каждого сост-я опред-ся с точностью до аддитивной постоянной (важнее роль значения не S, а dS).
4) Для обрат. процессов изменение S сис-мы =

5) Единица измерения энтропии: [S]=Дж/К
6) По характеру изм. S можно судить о направлении протек-я процессов:
Т >0,  ,
,  > 0,
> 0,  > 0 - сис-ма получает тепло. Если сис-ма получает тепло, то энтропия её увелич. Если
> 0 - сис-ма получает тепло. Если сис-ма получает тепло, то энтропия её увелич. Если  < 0,
< 0,  < 0, сис-ма отдаёт тепло.
< 0, сис-ма отдаёт тепло.
7) По самому определ. энтропии она явл-ся аддитивной величиной, т.е. энтропия сис-мы равна сумме энтропий её частей.
8) При обратимом процессе  , а если процесс ещё и адиабатный, то
, а если процесс ещё и адиабатный, то  = 0 →
= 0 →  = 0, S = const, по этому адиабатический процесс - есть изэнтропический. Обратим. адиабата - есть изентропа.
= 0, S = const, по этому адиабатический процесс - есть изэнтропический. Обратим. адиабата - есть изентропа.
9) 1 и 2-ое НТ записанные совместно приводят к осн. Термодинамическому тождеству:  ,
, 
10) Найдём изм. S идеального газа при переходе его из сост. 1 в сост. 2 обратимым образом:  ;
;
 , по скольку
, по скольку  ;
;  ;
;  ;
; 

- изменение энтропии
Если расм. изотерм-ий переход, когда  -
-  .
.
Пусть два тела с различными температурами приведены в соприкосн и пусть вырав-е темпер-ры происходит медленно:


 .
.
11) Покажем, что энтропия есть мера обесцененности внутр энергии сис-мы. Основное термодинам-е тождество:
 или
или 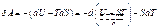 ;
;

Пусть процесс явл. изотермическим  ;
;  .
.
Тогда свободная энергия F сис-мы есть мера той работы, кот сис-ма может совершить в обратимом изотермич-ом процессе. Т.к. внутр энергия сис-мы  , то внутр энергия – есть сумма своб энергии F и связанной энергии TS. Энергия TS – есть та часть внутр энергии, кот не может быть превращена в работу. Эта связанная энергия TS тем больше, чем больше энтропия S. Отсюда S – есть мера обесцененности внутр энергии сис-мы, т.е. эта та часть энергии, кот не может быть обращ в работу
, то внутр энергия – есть сумма своб энергии F и связанной энергии TS. Энергия TS – есть та часть внутр энергии, кот не может быть превращена в работу. Эта связанная энергия TS тем больше, чем больше энтропия S. Отсюда S – есть мера обесцененности внутр энергии сис-мы, т.е. эта та часть энергии, кот не может быть обращ в работу
|
|
|
|
|
|


