 |
Теплопроводность. Коэффициент теплопроводности.
|
|
|
|
Теплопроводность в газе – направленный перенос кинетической энергии молекул за счет хаотичного теплового движения молекул и их сталкивании. При наличии неоднородной температуры, в результате чего происходит выравнивание температур в газе до достижения полного равновесия.
Рассмотрим одномерный случай:
Рассмотрим одноатомный газ и пусть градиент температуры равен 
2 предположения, компенсирующие друг друга:
1) будем считать, что в соседних слоях средняя энергия различна, а средняя скорость – одинаковая.
2) концентрация молекул в соседних слоях одинаковая n

Тепловой поток через площадь  за время
за время  равен:
равен:

Тогда тепловой поток проходящий через единицу площади за единицу времени:

Тепловой поток пропорционален градиенту температуры. Знак ‘‘минус’’ – q направлено в сторону убывания температуры. Коэффициент теплопроводности численно равен количеству тепла, проходящего через единицу площади соприкасающихся слоев за единицу времени, при градиенте температуры равном (-1).

Уравнение теплопроводности.
Уравнение теплопроводности описывает процесс переноса тепла в одномерном случае.

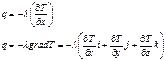
Цилиндр АВ расположен вдоль оси х, плотность газа  длина поперечного сечения
длина поперечного сечения 
Тепло, поступающее в цилиндр за время dt через основание А равно: 
Тепло, выходящее из цилиндра

Тепло, поступающее в цилиндр АВ

С другой стороны это тепло можно представить виде: 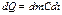
dm- масса газа: 
с-удельная теплоемкость: 
Приравниваем

В двумерном

К уравнению теплопроводности необходимо задать граничные и начальные условия, тогда приходим к краевой задачи Коши:

66 - 69
Изотермы Ван-дер-Ваальса. Критич. состояние. Внутр. энергия реального газа.
|
|
|
 Ур-ние ВдВ явл. ур-нием относит. объёма V:
Ур-ние ВдВ явл. ур-нием относит. объёма V:  (умножим рав-во на
(умножим рав-во на  ) Кубич. ур-ние имеет 3 корня (либо все корни действит., либо 1-о действит., а 2 комлексно-сопряжённых
) Кубич. ур-ние имеет 3 корня (либо все корни действит., либо 1-о действит., а 2 комлексно-сопряжённых  ) Уравнение для изотерм ВдВ им. вид:
) Уравнение для изотерм ВдВ им. вид:
При некот. Тк изотерма буд. иметь точку перегиба.Изотерма реального газа отлич. от изотерм ВдВ. Волнообразн. участок ур-ния
ВдВ замен-ся на линейный (экспериментально получил Эндрюс):
 При темпер >Тк вещ-во существ. только в газообразн. сост. и никаким сжатием нельзя его перевести в жидк. состояние.Найдём внутр. энергию реал. газа (ВдВ) Внутр. энергия складыв. с кинетич. и потенц. энергии, т.е.
При темпер >Тк вещ-во существ. только в газообразн. сост. и никаким сжатием нельзя его перевести в жидк. состояние.Найдём внутр. энергию реал. газа (ВдВ) Внутр. энергия складыв. с кинетич. и потенц. энергии, т.е.  ; ν=1 моль;
; ν=1 моль;  ; p*
; p*  (избыточн. внутр. давл.)Работа на преодол. сил сцепл. молекул идёт на увелич. потенц. энергии реал. газа δА=р*
(избыточн. внутр. давл.)Работа на преодол. сил сцепл. молекул идёт на увелич. потенц. энергии реал. газа δА=р*  ; А=
; А=  =
=  =‒
=‒  +const=Ep (const=0); внутр.энерг.ид.газа
+const=Ep (const=0); внутр.энерг.ид.газа  =
= 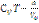
Твёрдые тела.Теплоёмкость кристалла
Тв. тела отлич. от газообр. и жидкю постоянством формы, V. Они делятся на кристаллич. и аморфные.Большее число тв. тел кристалл-кие. Для кристаллов харак-но наличие кристаллич. решётки. Кристалл как правило проявл. анизотропные физ. св-ва (разные по разным направл.) Аморфные тела – переохлажд. жидкости(стекло, смола, битум). Они проявл. изотропные св-ва. Вычислим теплоёмк. кристалла.Т.к. V тв. тел маломеняется, то теплоёмк Cp и CV примерно одинаковы и можно говорить просто о теплоёмкости С. Внутр. энергия крист. решётки тв. тела сост. из кинетич. и потенц. энергии атомов и ионов в узлах этой решётки. При этом на кажд. степ. свободы приход-ся  kT в виде кинетич. энергии и
kT в виде кинетич. энергии и  kT в виде потенц. энергии.
kT в виде потенц. энергии.  kT+
kT+  kT=kT. Т.к. атом имеет 3 степ. свободы, то энергия атома будет 3kT. Так как 1 моль содерж NА атомов, то внутр. энергия U= NА
kT=kT. Т.к. атом имеет 3 степ. свободы, то энергия атома будет 3kT. Так как 1 моль содерж NА атомов, то внутр. энергия U= NА  3kT=3RT. Теплоёмкость С=
3kT=3RT. Теплоёмкость С=  =
=  +
+  (
( =0); C=3R ≈25
=0); C=3R ≈25 
З-н Дюлонга и Пти (1815). «Молярн. теплоёмк. кристаллич. атомарных тел одинакова и равна 3R».
 При низк. темпер. наблюд. отклонение от з-на Дюл. и Пти, при этом происх. постеп. «вымерзание» колебательн. степеней свободы.При низк. темп. теплоёмк. мен-ся по з-ну С= const∙
При низк. темпер. наблюд. отклонение от з-на Дюл. и Пти, при этом происх. постеп. «вымерзание» колебательн. степеней свободы.При низк. темп. теплоёмк. мен-ся по з-ну С= const∙  (з-н П.Дебая)
(з-н П.Дебая)
|
|
|
На графике з-н Дебая им. вид:
|
|
|


