 |
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
|
|
|
|
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
2. Термохимия. Закон Гесса. Теплоемкость. Закон Кирхгоффа.
Термохимия изучает тепловые эффекты химических реакций. При постоянном объеме теплота равна изменению внутренней энергии: QV=Δ U, а при постоянном давлении – изменению энтальпии: QР=Δ U.
Эти равенства в применении к химическим реакциям составляют суть закона Гесса: Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т. е. если Δ H < 0 или Δ U < 0. Под тепловым эффектом химической реакции понимают значение Δ H (которое называют просто " энтальпией реакции" ) или Δ U реакции.
Если в реакции участвуют идеальные газы, то при постоянной температуре
Δ H = Δ U + Δ (pV) = Δ U + Δ n . RT, где Δ n – изменение количества моль газов в реакции.
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие " стандартного состояния". Стандартное состояние – это состояние чистого вещества при давлении 101, 3 кПа и температуре 25º С. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, обозначают  . В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
. В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
|
|
|
Следствие 1. Стандартная энтальпия химической реакции равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
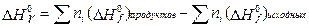
Стандартной энтальпией (теплотой) образования вещества  называют энтальпию реакции образования одного моль этого вещества из элементов, находящихся в наиболее устойчивом стандартном состоянии. Согласно этому определению, энтальпия образования
называют энтальпию реакции образования одного моль этого вещества из элементов, находящихся в наиболее устойчивом стандартном состоянии. Согласно этому определению, энтальпия образования
Следствие 2. Стандартная энтальпия химической реакции
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
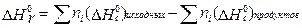
Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моль вещества.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связиA- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние.
Большинство термохимических данных в справочниках приведено при температуре 298 К.
Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
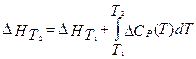 , где Δ Cp - разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T2 - T1 невелика, то можно принять Δ Cp = const. При большой разнице температур необходимо использовать температурную зависимость Δ Cp(T) типа:
, где Δ Cp - разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T2 - T1 невелика, то можно принять Δ Cp = const. При большой разнице температур необходимо использовать температурную зависимость Δ Cp(T) типа:
Δ Ср(Т) = Δ а + Δ bT + Δ сТ2 + Δ с'/Т2, , где коэффициенты a, b, c и т. д. для отдельных веществ берут из справочника, а знак Δ обозначает разность между продуктами и реагентами (с учетом коэффициентов).
|
|
|


