 |
4. Задачи для аудиторной самостоятельной работы.
|
|
|
|
4. Задачи для аудиторной самостоятельной работы.
4-1. Рассчитайте изменение энтропии при нагревании 11, 2 л азота от 0 до 50 оС и одновременном уменьшении давления от 101, 3 кПа до 1, 013 кПа.
4-2. Рассчитайте изменение энтропии при образовании 1 м3 воздуха из азота и кислорода (20 об. %) при температуре 25 оС и давлении 101, 3 кПа.
4-3. Рассчитайте изменение энтропии при нагревании 0, 7 моль моноклинной серы от 25 до 200 оС при давлении 101, 3 кПа. Мольная теплоемкость серы равна: Cp(Sтв) = 23, 64 Дж/(моль. К), Cp(Sж) = 35, 73 + 1, 17. 10-3T Дж/(моль. К). Температура плавления моноклинной серы 119 оС, удельная теплота плавления 45, 2 Дж/г.
4-4. Используя справочные данные рассчитайте изменение энтропии при протекании реакции при 300 °С H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
5. Задачи для внеаудиторной самостоятельной работы.
5-1. Рассчитайте изменение энтропии при нагревании 0, 4 моль хлорида натрия от 20 до 850 оС. Мольная теплоемкость хлорида натрия равна: Cp(NaClтв) = 45, 94 + 16, 32 10-3T Дж/(моль. К), Cp(NaClж) = 66, 53 Дж/(моль. К). Температура плавления хлорида натрия 800 оС, теплота плавления 31, 0 кДж/моль.
5-2. Вычислить изменение энтропии при нагревании 16 кг О2 от 273 до 373 К; 1) при постоянном объеме; 2) при постоянном давлении. Считать кислород идеальным газом.
5-3. Рассчитать изменение энтропии при нагревании 58, 82 кг В2О3 от 298 до 700 К, теплоемкость СР (В2О3) = 36, 6·103 +106, 3 ·T Дж/кмоль·К.
5-4. Бромбензол кипит при 429, 8 К, его теплота парообразования при этой температуре 241, 9 Дж/г. Рассчитать изменение энтропии при испарении 10 кг бромбензола.
5-5. Под давлением 196 кПа нагревают 2 л аргона до тех пор, пока объем его не увеличится до 12 л. Каково изменение энтропии, если начальная температура 373 К?
|
|
|
5-6. Вычислить изменение энтропии при охлаждении 12 г кислорода от 290 до 233 К и одновременном повышении давления от 101, 3 кПа до 6060 кПа, если СР = 32, 9 Дж/кмоль·К.
5-7. Рассчитать изменение энтропии в процессе смешения 5 кг воды при 353 К с 10 кг воды при 290 К. Теплоемкость воды считать постоянной и равной 4, 2 Дж/кмоль·К.
5-8. Рассчитать общее возрастание энтропии при смешении 0, 1 л кислорода с 0, 4 л азота при 280 К и 101, 3 кПа. V = const.
5-9. Определить изменение энтропии, если 100 г воды, взятой при 273 К, превращается в пар при 390 К. Удельная теплота испарения воды при 373 К равна 2263, 8 Дж/г; удельная теплоемкость жидкой воды 4, 2 Дж/г·К; удельная теплоемкость пара при постоянном давлении 2, 0 Дж/г·К.
5-10. Пользуясь справочными данными, рассчитайте стандартное изменение энтропии в реакции H2(г) + ЅO2(г) = H2O(г) а) при 25 оС; б) при 300 оС.
6. Задание для самостоятельной работы.
Рассчитайте изменение энтропии при протекании выбранной вами реакции при данной температуре.
Занятие № 5.
План занятия:
1. Тестовый контроль знаний по теме «Второй закон термодинамики. Энтропия, расчет энтропии системы в различных процессах».
2. Термодинамические потенциалы. Химическое равновесие.
3. Решение задач на тему «Термодинамические потенциалы. Химическое равновесие».
1. Тестовый контроль знаний по теме «Второй закон термодинамики. Энтропия, расчет энтропии системы в различных процессах».
1. Укажите математическое соотношение между изменением энтропии и теплотой необратимого процесса.
1.  . 2.
. 2. 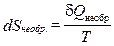 . 3.
. 3.  . 4.
. 4. 
2. Какие данные необходимы для расчета изменения энтропии в процессе превращения 1 моль воды, взятой в виде льда при 0°С, в пар при 200°С и давлении 101, 3 кПа?
1. Теплота плавления льда при 0°С, разность теплоемкостей воды в жидком и газообразном состояниях при 100°С и при 200°С, а также теплота испарения воды при 100°С.
|
|
|
2. Теплота плавления льда при 0°С, значения средних теплоемкостей жидкой воды и водяного пара в интервалах соответственно 0°-100°С и 100°-200°С и молярные объемы жидкой, и газообразной воды при температурах 100° и 200°С.
3. Теплоемкость льда при 0°С, теплота испарения при 100°С, средняя теплоемкость водяного пара в интервале 100°- 200°С и разность объёмов водяного пара при 200°и 100°С.
4. Теплота плавления льда при 0°С, зависимость от температуры теплоемкости жидкой воды в интервале 0°-100°С и водяного пара в интервале 100°-200°С, а также теплота испарения воды при нормальной температуре кипения.
|
|
|


