 |
3. Укажите, какие справочные данные необходимы для расчета с возможно большей точностью теплового эффекта следующей реакции при 500 К: СО + 3Н2 = СН4 + Н2О.
|
|
|
|
3. Укажите, какие справочные данные необходимы для расчета с возможно большей точностью теплового эффекта следующей реакции при 500 К: СО + 3Н2 = СН4 + Н2О.
1. Теплота образования воды, метана и оксида углерода в стандартных условиях при 25 º С и эмпирические коэффициенты уравнения зависимости теплоемкости от температуры для всех веществ – участников реакции.
2. Теплоты образования при 25 º С метана, воды, оксида углерода и молекулярного водорода.
3. Теплоты сгорания всех веществ – участников реакции и их средние теплоемкости.
4. Теплоты сгорания воды, метана и оксида углерода при 500 º С.
4. Каково соотношение между тепловым аффектом при постоянном давлении и постоянном объеме в интервале температур от 298 К до 600 К для реакции 2СО = СО2 + С?

4. Определенный вывод можно сделать только на основании данных о конкретных условиях протекания реакции (Т, Р).
5. Что называется стандартной теплотой образования данного вещества?
1. Тепловой эффект образования данного соединения из элементов при 298 К и давлении 1 атм.
2. Тепловой эффект образования данного соединения из простых веществ при 298 К и давлении 1 атм.
3. Тепловой эффект образования данного соединения из простых веществ при 0°С и давлении 1 атм.
4. Тепловой эффект образования данного соединения из элементов, находящихся в стандартном состоянии.
6. В справочнике отсутствует величина теплоты сгорания бензилового альдегида. Какие данные нужны для ее расчета при 298 К?
1. Теплота сгорания альдегида, углекислого газа и воды.
2. Теплоты восстановления оксидов-продуктов сгорания.
3. Зависимость теплоты образования бензилового альдегида от температуры.
|
|
|
4. Теплота образования альдегида, углекислого газа и воды.
7. Какими данными надо располагать, чтобы рассчитать тепловой эффект реакции при любой заданной температуре?
1. Необходимо иметь тепловой эффект этой реакции при любой другой температуре, зависимость теплоемкостей конечных и начальных веществ от температуры в этом интервале температур и знать теплоты фазовых превращений, если таковые имеют место в этом интервале температур.
2. Надо знать стандартный тепловой эффект этой реакции и теплоемкости всех реагирующих веществ.
3. Надо знать константу интегрирования уравнения Кирхгоффа.
4. Надо знать тепловой эффект этой реакции при какой-либо температуре и температурные зависимости теплоемкостей веществ-участников реакции.
8. Что называют тепловым эффектом химической реакции?
1. Теплота разложения всех веществ-участников реакции на простые вещества.
2. Теплота, которая выделяется в ходе реакции при переходе от начального состояния к конечному.
3. Количество энергии, которое система выделяет или поглощает при полном необратимом протекании реакции в виде тепла при условии, что остается постоянным давление или объем системы.
4. Теплота, которая выделяется или поглощается в ходе данной реакции.
9. Изменение теплоемкости в ходе реакции в некотором интервале температур меньше нуля. Как изменяется тепловой эффект этой реакции при повышении температуры в данном интервале?
1. С ростом температуры тепловой эффект будет увеличиваться.
2. Тепловой эффект может и возрастать и убывать; это зависит от знака теплового эффекта реакции.
3. С ростом температуры тепловой эффект будет уменьшаться.
4. Ответить на поставленный вопрос невозможно, не зная конкретной реакции.
10. Какова связь между тепловым эффектом при постоянном объеме Qv и постоянное давлении Qр для реакции: СО + 3Н2= СН4 + Н2О(ж)?
|
|
|
1.  2.
2. 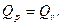 3.
3. 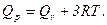 4.
4. 
Задача №1. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме
FeS + 2HCl = FeCl2 + H2S.
Задача №2. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме 2H2S + 3O2 = 2H2O + 2SO2.
Задача №3. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме 2H2S + O2 = 2H2O + S.
Задача №4. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl. .
Задача №5. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме H2SO3 + Cl2 + H2O = H2SO4 + 2HCl.
Задача №6. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме 4Na2SO3 = 3Na2SO4 + Na2S.
Задача №7. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме H2SO3 + 2H2S = 3S + 3H2O.
Задача №8. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме 2HBr + H2SO4 = Br2 + SO2 + 2H2O.
Задача №9. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме C + 2H2SO4 = CO2 + 2SO2 + 2H2O.
Задача №10. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях при постоянном давлении и при постоянном объеме SO2 + NO2 + H2O = H2SO4 + NO.
|
|
|


