 |
3. Решение задач на тему «Термохимия. Закон Гесса. Теплоемкость. Закон Кирхгоффа».
|
|
|
|
3. Решение задач на тему «Термохимия. Закон Гесса. Теплоемкость. Закон Кирхгоффа».
3-1. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях CH4 + Cl2 = CH3Cl + HCl.
3-2. Теплоты горения алмаза и графита соответственно равны -395, 7 кДжи -393, 77 кДж. Вычислите теплоту образования алмаза из графита.
3-3. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях СаС2 + 2Н2О = Са(ОН)2 + С2Н2.
3-4. Используя справочные данные рассчитайте тепловой эффект реакции при стандартных условиях Fe2O3 + 3СО = 2Fe + 3СО2.
3-5. Определите теплоты образования при постоянном объеме и 25 °С, если известна теплота образования при постоянном давлении для следующих реакций:
а) Н2 + 1/2O2 = Н2О(Г), ∆ H10 = - 242 кДж;
б) 1/2N2 + 3/2Н2 =NН3, ∆ H20 = - 46, 2 кДж;
в) 1/2H2 + 1/2F2 = HF, ∆ H30= - 268, 8 кДж;
г) 1/2N2 + О2 = NО2, ∆ H40 = 33, 87 кДж.
3-6. Стандартная энтальпия реакции CaCO3(тв) = CaO(тв) + CO2(г), протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-7. Рассчитайте энтальпию образования N2O5(г) при T = 298 К на основании следующих данных:
2NO(г) + O2(г) = 2NO2(г), Δ H10 = -114, 2 кДж,
4NO2(г) + O2(г) = 2N2O5(г), Δ H20 = -110, 2 кДж,
N2(г) + O2(г) = 2NO(г), Δ H30 = 182, 6 кДж.
3-8. Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных:
B2H6(г) + 3O2(г) = B2O3(тв) + 3H2O(г), Δ H10 = -2035, 6 кДж,
2B(тв) + 3/2 O2(г) = B2O3(тв), Δ H20 = -1273, 5 кДж,
H2(г) + 1/2 O2(г) = H2O(г), Δ H30 = -241, 8 кДж.
3-9. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных:
|
|
|
ZnS = Zn + S, Δ H10 = 200, 5 кДж,
2ZnS + 3O2 = 2ZnO + 2SO2, Δ H20 = -893, 5 кДж,
2SO2 + O2 = 2SO3, Δ H30 = -198, 2 кДж,
ZnSO4 = ZnO + SO3, Δ H40 = 235, 0 кДж.
3-10. Используя справочные данные рассчитайте тепловой эффект реакции
CH4 + Cl2 = CH3Cl(г) + HCl
при температуре 200 º С.
3-11. Используя справочные данные рассчитайте тепловой эффект реакции
СаС2 + 2Н2О(Ж) =Са (ОН)2 + С2Н2
при температуре 150 º С.
3-12. Используя справочные данные рассчитайте тепловой эффект реакции
Fe2O3 + 3СО = 2Fe + 3СО2
при температуре 850 º С.
4. Задачи для аудиторной самостоятельной работы.
4-1. Вычислите тепловой эффект реакции восстановления оксида FeO водородом, пользуясь следующими данными:
FeO + СО = Fe+ СО2, Δ H10 = - 13, 19 кДж
CO+ 1/2О2= CО2 Δ H20 = - 283, 2 кДж;
Н2 + 1/2О2 = Н2ОГ, Δ H30 = - 242 кДж.
4-2. Используя справочные данные рассчитайте тепловой эффект реакции при постоянном давлении при 525 °С 2NH4C1 + Н2SО4 = (NH4)2SО4 + 2НС1.
5. Задачи для внеаудиторной самостоятельной работы.
5-1. Вычислите тепловой эффект реакции при постоянном давлении при 525 °С 4NH3 + 5O2 = 6Н2О + 4NO
5-2. Вычислите тепловой эффект реакции при постоянном давлении при 700 °С
CH4 + CО2 = 2CО + 2H2
5-3. Вычислите теплоту образования серного ангидрида, исходя из следующих данных:
РbО + Sромб + 3/2О2 = PbSО4, Δ H10 = - 693, 3 кДж;
РbО + H2SO4·5Н2О = PbSO4 + 6Н2О, Δ H20 = - 97, 55 кДж;
SO3 + 5Н2О = H2SО4·5Н2О, Δ H30 = - 172, 1 кДж.
6. Задание для самостоятельной работы.
Выберите химическую реакцию и температуру при которой она протекает, и рассчитайте тепловой эффект этой реакции при данной температуре. (Температура не должна быть равна стандартной).
Занятие № 4.
План занятия:
1. Тестовый контроль знаний по теме «Первое начало термодинамики, Расчет работы расширения идеального газа в различных условиях».
|
|
|
2. Второй закон термодинамики. Энтропия, расчет энтропии системы в различных процессах.
3. Решение задач на тему «Второй закон термодинамики. Энтропия, расчет энтропии системы в различных процессах».
1. Тестовый контроль знаний по теме «Термохимия. Закон Гесса. Теплоемкость. Закон Кирхгоффа».
 1. Стандартная теплота образования жидкого нитробензола равна 11, 2 кДж/моль. Укажите уравнение реакции, к которой относится этот тепловой эффект.
1. Стандартная теплота образования жидкого нитробензола равна 11, 2 кДж/моль. Укажите уравнение реакции, к которой относится этот тепловой эффект.
2. Как зависит тепловой эффект химической реакции от температуры?
1. В зависимости от знака  в данном интервале температур: растет, если
в данном интервале температур: растет, если  > 0; уменьшается, если
> 0; уменьшается, если  < 0, или не меняется, если
< 0, или не меняется, если  = 0.
= 0.
2. Растет с ростом температуры, если одновременно увеличивается  .
.
3. При увеличении температуры тепловой эффект всегда растет.
4. При увеличении температуры растет, если одновременно возрастает величина 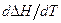 .
.
|
|
|


