 |
4. Метод исследования разбавленных растворов, основанный на сравнении температуры начала кипения раствора и температуры кипения растворителя, -..
|
|
|
|
4. Метод исследования разбавленных растворов, основанный на сравнении температуры начала кипения раствора и температуры кипения растворителя, -...
1. калориметрия. 2. тензиметрия.
3. криоскопия. 4. эбуллиоскопия.
5. Метод исследования разбавленных растворов, основанный на сравнении температуры начала отвердевания раствора и температуры плавления растворителя, -...
1. калориметрия. 2. тензиметрия.
3. криоскопия. 4. эбуллиоскопия.
6. В идеальном растворе давление насыщенного пара растворителя …
1. уменьшается с ростом концентрации.
2. постоянно.
3. увеличивается с ростом концентрации.
4. меняется в зависимости от природы растворенного вещества.
7. Закон Рауля определяет зависимость давления пара растворителя от …
1. концентрации.
2. температуры.
3. природы растворителя.
4. природы растворенного вещества.
8. Раствор начинает кипеть, когда давление пара растворителя над раствором …
1. равно внешнему давлению.
2. равно давлению пара растворенного вещества.
3. меньше внешнего давления.
4. больше внешнего давления.
9. Понижение давления пара растворителя над раствором равно …
1. мольной доли растворителя.
2. мольной доли растворенного вещества.
3. количеству растворителя.
4. количеству растворенного вещества.
10. Криоскопическая постоянная зависит от …
1. природы растворителя.
2. природы растворенного вещества.
3. температуры замерзания раствора.
4. температуры замерзания растворенного вещества.
Задача №1. Давление пара воды при 50 °С равно 12, 3 кПа. Сколько граммов глюкозы нужно растворить в 270 гводы, чтобы давление пара над раствором понизилось на 0, 07 кПа.
|
|
|
Задача №2. Определите (в процентах) относительное понижение давления пара над раствором, содержащим 4, 14 гсалициловой кислоты (C7H6O3) в 100 гэтилового спирта.
Задача №3. Определите концентрацию (в молях на 1000 г воды) раствора мочевины. Давление пара над раствором при 25 °С равно 3, 1 кПа. Давление пара воды при этой температуре 3, 17 кПа.
Задача №4. Давление пара над раствором, содержащим 2, 55 гнафталина в 234 гбензола, при 20 °С равно 9, 9 кПа. Давление пара над чистым бензолом при этой температуре равно 10, 0 кПа. Вычислите молекулярную массу нафталина и относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
Задача №5. Сколько бензойной кислоты (С7Н6О2) растворено в 100 г уксусной кислоты, если температура замерзания последней понизилась на 0, 824°? Криоскопическая постоянная уксусной кислоты 3, 9.
Задача №6. Нафталин (0, 5685 г), растворенный в 25 г n-толуидина (C7H9N), дал понижение точки замерзания раствора на 0, 942°. Температура плавления чистого n-толуидина равна 43 °С. Определите криоскопическую постоянную и скрытую теплоту плавления п-толуидина.
Задача №7. Какова концентрация в процентах по массе водного раствора фруктозы, который замерзает при температуре -0, 524 °С? Криоскопическая постоянная воды 1, 86.
Задача №8. Определите температуру кипения раствора, содержащего 0, 006 молькамфоры в 20 г ацетона. Температура кипения ацетона 56, 3 °С, а удельная теплота его испарения при этой температуре 540, 0 Дж/г.
Задача №9. Раствор бензойной кислоты в эфире (концентрация раствора равна 2%) кипит при такой же температуре, как раствор, содержащий 0, 645 гнеизвестного вещества в 22, 5 гэфира. Вычислите молекулярную массу неизвестного вещества. Эбуллиоскопическая постоянная эфира равна 2.
|
|
|
Задача №10. Из опыта найдено, что при растворении 0, 374 гбензила (С14Н10О2) в 33, 05 гхлороформа повышение температуры кипения было равно 0, 202 °С. Вычислите эбуллиоскопическую постоянную хлороформа и удельную теплоту его испарения при температуре кипения 61, 2 °С.
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
2. Давление пара над раствором. Осмос. Растворимость газов в жидкостях. Закон Генри. Перегонка жидких смесей.
Осмотическое давление p в разбавленных растворах можно рассчитать по уравнению
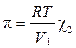 , где χ 2 – мольная доля растворенного вещества, V1 – мольный объем растворителя. В очень разбавленных растворах это уравнение преобразуется в уравнение Вант-Гоффа:
, где χ 2 – мольная доля растворенного вещества, V1 – мольный объем растворителя. В очень разбавленных растворах это уравнение преобразуется в уравнение Вант-Гоффа:
π = CRT, где C – молярная концентрация раствора.
Зависимость растворимости газов в жидкости от давления подчиняется закону Генри:
Р=Гχ
где χ – мольная доля газа в растворе; Р – давление газа над раствором; Г – постоянная Генри.
Растворимость газов в жидкостях может выражаться с помощью коэффициента растворимости или растворимости и коэффициента адсорбции.
Коэффициент растворимости или растворимость газа (β ) определяется как измеренный при данной температуре и равновесном давлении объем газа, который растворяется в одном объеме жидкости.
Коэффициент абсорбции (α ) представляет собой приведенный к 0 °С и давлению 101, 3 кПа. объем газа, растворенного в одном объеме жидкости при температуре опыта и парциальном давлении газа, равном 101, 3 кПа.
|
|
|


