 |
Химико-технологического процесса
|
|
|
|
Энергетический (тепловой) баланс – это вещественное выражение закона сохранения энергии (тепла), согласно которому:
åQприх. = åQрасх. +åQпот. (4.1)
Левую часть уравнения составляет тепло всех входящих энергетических потоков в элемент (подсистему) ХТС, а правую – тепло выходящих энергетических потоков и энергетические потери.
Цель расчета энергетического баланса заключается в определении количества тепла, которое необходимо подвести (или отвести) из зоны реакции для поддержания постоянной температуры или заданного теплового режима, то есть определить так называемую тепловую нагрузку на реактор. Для элементов (подсистем) ХТС, в которых, наряду с процессами теплообмена происходят химические и фазовые превращения, сопровождающиеся выделением или поглощением тепла, уравнение теплового баланса принимает вид:
Qреаг ± Qr. ± Qф ± QF = Qпрод,+ Qнагр. + Qпот., (4.2)
где Qреаг – тепло, входящее в реактор с исходными реагентами:
Qреаг, i = Gi×Cpi×Ti, Qреаг  Qреаг,i , (4.3)
Qреаг,i , (4.3)
где; Gi – мольный поток i - реагента; Срi – теплоемкость i - реагента, Дж/моль∙К; Тi – температура i - реагента, К; m-количество веществ, входящих в реактор.
Теплоемкость для неорганических и органических веществ рассчитывают по формулам:
Cpi = а + вТ + с’ /Т2, Cpi = а + bT + cT2, (4.4)
где а, в, с, с’ - коэффициенты для расчета теплоемкости (справочные величины)
±Qr – тепло, выделяющееся (или поглощающееся) в результате химических превращений:
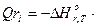 Gi(j),
Gi(j),  , (4.5)
, (4.5)
где  – тепло, выделяющееся (или поглощающееся) в результате отдельной i –химической реакции;
– тепло, выделяющееся (или поглощающееся) в результате отдельной i –химической реакции; 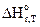 – тепловой эффект i - химической реакции, кДж/моль; Gi(j) – мольный поток i - реагента, вступившего в реакции (или полученного j - продукта реакции.), m-количество химических реакций, протекающих в системе. Тепловой эффект при температуре химической реакции рассчитывают по уравнению:
– тепловой эффект i - химической реакции, кДж/моль; Gi(j) – мольный поток i - реагента, вступившего в реакции (или полученного j - продукта реакции.), m-количество химических реакций, протекающих в системе. Тепловой эффект при температуре химической реакции рассчитывают по уравнению:
|
|
|
 , (4.6)
, (4.6)
где  - тепловой эффект химической реакции при температуре 298 К, Dа, Db, Dc, - разности коэффициентов. Значения этих величин определяют по следствию из закона Гесса, используя справочные данные:
- тепловой эффект химической реакции при температуре 298 К, Dа, Db, Dc, - разности коэффициентов. Значения этих величин определяют по следствию из закона Гесса, используя справочные данные:
 (4.7)
(4.7)
 . (4.8)
. (4.8)
 (4.9)
(4.9)
 (4.10)
(4.10)
 – тепло, выделяющееся (или поглощающееся) в результате фазовых превращений:
– тепло, выделяющееся (или поглощающееся) в результате фазовых превращений:
 Gi(j),
Gi(j),  , (4.11)
, (4.11)
где  – энтальпия i - фазового перехода, кДж/моль; Gi(j) – мольный поток i- реагента, участвующего в реакции (или полученного) j - продукта реакции, претерпевающего фазовый переход.
– энтальпия i - фазового перехода, кДж/моль; Gi(j) – мольный поток i- реагента, участвующего в реакции (или полученного) j - продукта реакции, претерпевающего фазовый переход.
Наличие фазового перехода устанавливают на основании сравнения температур фазовых превращений (кипения, плавления и так далее) подаваемых исходных реагентов и полученных продуктов реакции, с температурой на выходе из реактора и в зоне реакции.
Qпрод – тепло, выходящее из реактора с продуктами реакции:
Qпрод, j = Gj×Cpj×Tj, Qпрод  Qпрод, j, (4.12)
Qпрод, j, (4.12)
где Gj –мольный поток j - продукта реакции; СPj – средняя теплоемкость j - продукта реакции, Дж/моль∙К; Тj – температура j - продукта реакции, К.
Qнагр – количество тепла, расходуемое на нагревание исходных реагентов до температуры реакции:
 Qнагр,i = Gi×Cpi× (Tj – Ti), (4.13)
Qнагр,i = Gi×Cpi× (Tj – Ti), (4.13)
Qнагр.  Qнагр,i, (4.14)
Qнагр,i, (4.14)
где Gi – мольный поток i - реагента, подвергаемый нагреву;
 СPi – средняя теплоемкость i – реагента (рассчитывают при средней температуре между температурой на входе в реактор и температурой в зоне реакции), Дж/моль∙К; Тi – температура i- реагента на входе в реактор; Тj,r – температура j - реагента в зоне реакции.
СPi – средняя теплоемкость i – реагента (рассчитывают при средней температуре между температурой на входе в реактор и температурой в зоне реакции), Дж/моль∙К; Тi – температура i- реагента на входе в реактор; Тj,r – температура j - реагента в зоне реакции.
Для изотермической реакции (Tj – Ti) = 0
Qпот – тепловые потери (1 – 5% от прихода тепла);
Qпот = (0,01– 0,05)∙Qприх , (4.15)
Qприх = åQреаг ± åQr ± åQф (4.16)
±QF – количество тепла, отводимое (подводимое) от реактора при помощи теплоносителя (хладоагента):
±QF = Qрасх. - Qприх (4.17)
Qрасх = åQпрод,+ åQнагр. + åQпот (4.18)
|
|
|
Для систем (подсистем), работающих непрерывно, энергетический (тепловой) баланс составляют в виде теплового потока (кДж/час, кДж/мин и т.д.), а для периодически работающих элементов на время цикла (кДж).
Результаты расчета сводят в таблицу теплового баланса.
|
|
|


