 |
Методика проведения эксперимента
|
|
|
|
Для осуществления данного процесса в стаканы загружают 25 мл 7% раствора HCl или H2SO4. Затем вносят предварительно очищенный наждачной бумагой или раствором щелочи, взвешенный кусочек металла (0,5 - 2 гр.) на стеклянной палочке с ситообразным наконечником и начинают отсчет времени. Через определенные промежутки времени (по заданию преподавателя) стеклянную палочку с металлом вынимают из стакана, промывают холодной дистиллированной водой, высушивают на фильтровальной бумаге и взвешивают на аналитических весах. После извлечения металла из раствора кислоты останавливают секундомер и, взвесив его, помещают обратно в стакан, включают секундомер и продолжают отсчет времени.
Внимание: показание секундомера не обнуляют.
Для исследования влияния температуры эксперимент проводят при различных температурах (по заданию преподавателя). Результаты эксперимента записывают в таблицу 4.1.
ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Таблица 4.1.
Результаты экспериментальных исследований
| № опыта | Т, 0С | t, мин | mMe | m0Me | tп, мин | 
| XМе |
| … |
Определение лимитирующей стадии процесса
Степень превращения металлов (алюминия, цинка) определяют по формуле 4.1:
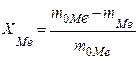 , (4.1)
, (4.1)
где  –масса исходного металла, г;
–масса исходного металла, г;
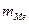 – масса металла после реакции, г.
– масса металла после реакции, г.
Для определения лимитирующей стадии строят график зависимости  от
от  и сравнивают с теоретическими кривыми, представленными на рис. 4.1.
и сравнивают с теоретическими кривыми, представленными на рис. 4.1.
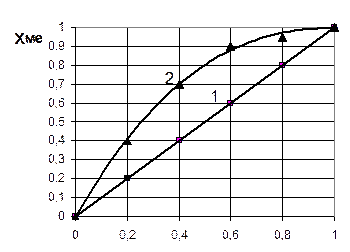

Рис 4.1. Зависимость степени превращения металла ХМе от отношения t/tn в зависимости от лимитирующей стадии процесса: 1 – внешнедиффузионная область; 2 – кинетическая область
|
|
|
После нахождения лимитирующей стадии для каждой из трех температур определяют константу скорости реакции из уравнения 2.3 (если реакция протекает в кинетической области).
По рассчитанным константам топохимического процесса определяют активационные параметры (энергию активации и частотный фактор Аррениуса) по уравнениям 4.2, 4.3 и результаты расчетов вносят в таблицу 4.2.
Аналитический метод определения энергии активации (Еакт)
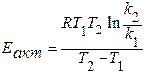 (4.2)
(4.2)
Частотный фактор Аррениуса (А) определяют из интегральной формы уравнения Аррениуса.
 (4.3)
(4.3)
Таблица 4.2.
Результаты расчета активационных параметров
| № | T, 0С | T, К | k | А | Еакт ,кДж/моль |
ЗАДАНИЕ
1. Построить зависимость степени превращения ХМе от t/tn и, сравнив с теоретическими кривыми, представленными на рис. 4.1, определить область протекания процесса.
2. Используя экспериментальные данные, рассчитать константу скорости химической реакции и активационные параметры (для процесса, протекающего в кинетической области)
3. Определить лимитирующую стадию по влиянию температуры на скорость химической реакции и по энергии активации.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Ход работы и порядок расчетов.
2. Модели топохимических процессов.
3. Механизм и кинетика топохимических процессов.
4. Методы определения лимитирующей стадии топохимических процессов.
5. Технологические методы интенсификации топохимических процессов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Попов, Ю. В. Руководство к практическим занятиям по инженерной химии: учеб. пособие / Ю. В. Попов, К. Ф. Красильникова, Т. К. Корчагина, Г. М. Бутов/ ВолгГТУ. – Волгоград, 2005. – 164 с.
2. Попов, Ю. В. Инженерная химия: учеб. пособие / Ю. В. Попов, Б. И. Но / ВолгГТУ. – Волгоград, 2003. – 208 с.
|
|
|
3. Игнатенко, В. Н. Примеры и задачи по химической технологии / В. Н. Игнатенко, В. С. Бесков. – М.: Академкнига, 2006. – 198 с.
4. Кутепов, А. М. Общая химическая технология / А. М. Кутепов, Т. Н. Бондарева, М. Г. Беренгартен. – М.: Высшая шк., 1990. – 520 с.
5. Краткий справочник физико-химических величин / под ред. К. П. Мищенко и А. А. Равделя. – Л.: Химия, 1974. – 200 с.
6. Бутов Г.М. Расчеты химико-технологических процессов: учеб. пособие / Бутов Г.М., Гаджиев Г., Саад К.Р./ВолгГТУ. – Волгоград, 2005.-88с.
ПРИЛОЖЕНИЯ
Таблица П 1
Термодинамические свойства веществ
| Вещество (ж) | DНr,298 кДж/моль | DSr,298 Дж/мольК | Cp298 Дж/мольК | |
| Этилбензол С8Н10 (г) | 29,8 | 360,5 | 128,41 | |
| Стирол (г) C8H8 | 147,4 | 345,1 | 122,09 | |
| Толуол (г) C7H8 | 50,0 | 319,7 | 103,8 | |
| Бензол (г) C6H6 | 82,93 | 269,2 | 81,67 | |
| Метан (г) СН4 | -74,8 | 186,2 | 35,79 | |
| Этилен (г) С2Н4 | 52,28 | 219,4 | 43,63 | |
| Уксусная кислота СН3СООН | -484.9 | 159.8 | 123.4 | |
| Этанол С2Н5ОН | -234,80 | 281,38 | 67,25 | |
| Изопропанол C3H7OH | -318.7 | 153.4 | ||
| Этиловый эфир уксусной кислоты С2Н5 ООС-СН3 | -469.5 | |||
| Изопропиловый эфир уксусной кислоты С3Н7ООС-СН3 | -359,9 | 250,8 | 189,8 | |
| Вода Н2О (ж) | -285,84 | 69,96 | 75,31 |
ОГЛАВЛЕНИЕ
| Введение | ||
| Лабораторная работка №1 | Исследование реакции дегидрирования этилбензола и составление материального и энергетического балансов процесса | |
| Лабораторная работка №2 | Исследование кинетики гомогенных химических реакций | |
| Лабораторная работа № 3 | Экспериментальное определение химического равновесия в гомогенных системах и термодинамический анализ химических процессов | |
| Лабораторная работа № 4 | Исследование кинетики реакции металлов с кислотами | |
| Библиографический список | ||
| Приложения |

Учебное издание
Геннадий Михайлович Бутов
Сергей Владимирович Дьяконов
Ольга Михайловна Иванкина
Карим Рамез Саад
Лабораторный практикум
|
|
|


