 |
Определение эфирного числа продукта
|
|
|
|
Эфирным числом называют число мг КОН, затрачиваемых на омыление сложных эфиров в веществе массой 1 грамм.
К смеси, оставшейся в колбе после определения кислотного числа, приливают дополнительно 25 мл 0,1 н раствора КОН водного, присоединяют обратный воздушный холодильник и нагревают на водяной бане в течение 1,5 часа. После охлаждения колбы ее содержимое титруют 0,1 н раствором HCl. Можно взять для этого определения чистый исходный продукт, но тогда будет получено "число омыления" (Ч.О.), так как
Э.Ч. = Ч.О. - К.Ч. (2)
Расчет эфирного числа ведется по формуле
Э.Ч. 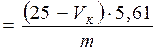 (3)
(3)
где 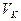 - объем 0,1 н раствора соляной (или серной) кислоты, пошедшей на титрование пробы;
- объем 0,1 н раствора соляной (или серной) кислоты, пошедшей на титрование пробы;
m - навеска пробы, г.
На основе стехиометрического уравнения основной реакции рассчитывают максимальное количество эфира, которое может быть получено. Сравнивая его с действительно полученным количеством эфира, определяют практический выход, %.
Строят графики на миллиметровой бумаге в координатах:
1) t, мин. - 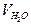 , мл; 2) t, мин.- lg
, мл; 2) t, мин.- lg 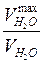
где  - предельно возможное выделение воды, получаемое стехиометрическим расчетом.
- предельно возможное выделение воды, получаемое стехиометрическим расчетом.
Графики можно совместить на одном листе, выстроив вторую ось справа. На их основании делают выводы об изменении скорости реакции по ходу процесса, о порядке реакции.
Конечные результаты экспериментов и расчетов сводят в табл.3
Таблица 3
| Масса эфира, г | 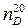 эфира эфира
| Э.Ч., мг КОН/г | К.Ч. | |||
| стехиом. | получено | справочн. | эксперим. | стехиом. | получено | мг КОН/г |
Тема 2. СУЛЬФИРОВАНИЕ
Сульфированием называют взаимодействие органического соединения с концентрированной серной кислотой и некоторыми ее производными, в результате которого атом водорода замещается сульфогруппой и образуются сульфокислоты.
|
|
|
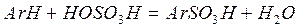
Сульфирование является одной из важнейших реакций органического синтеза ряда соединений (фенолы;  нафтол, крезолы, резорцин, красители, физиологически активные соединения, ПАВ). Кроме того, введение сульфогруппы используется для придания соединениям кислых свойств, растворимости в воде.
нафтол, крезолы, резорцин, красители, физиологически активные соединения, ПАВ). Кроме того, введение сульфогруппы используется для придания соединениям кислых свойств, растворимости в воде.
Сульфирующие агенты
1. Серная кислота концентрированная, 98-100 % моногидрат.
2. Олеум - дымящая серная кислота, содержащая 20-25 % или 60-65 %
SO3, растворенного в моногидрате.
3. Хлорсульфоновая кислота - монохлорангидрид серной кислоты, который получается из серного ангидрида и НСl.
Для сульфирования высокореакционных соединений, нестабильных в кислой среде, иногда применяют продукты присоединения серного ангидрида к пиридину или диоксану в избытке этих растворителей.
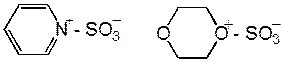
Наиболее часто для сульфирования применяют серную кислоту, реакция которой с ароматическими соединениями обратима. Скорость сульфирования очень сильно зависит от концентрации серной кислоты. Так как в реакции образуется вода, разбавляющая серную кислоту, скорость сульфирования может упасть до полного прекращения реакции. В связи с этим, массу сульфирующего агента, необходимого для проведения реакции, рассчитывают не по стехиометрическому соотношению, а по концентрации серной кислоты, которая должна получиться после завершения процесса сульфирования. Эта масса неодинакова для различных соединений и зависит от их реакционной способности. При прочих равных условиях она может быть тем ниже, чем активнее ароматическое соединение. Это явление характеризуют величиной " 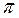 -сульфирования". Она численно равна массовой доле SO3 в отработанной кислоте, при которой сульфирование больше не идет. Например, для бензола
-сульфирования". Она численно равна массовой доле SO3 в отработанной кислоте, при которой сульфирование больше не идет. Например, для бензола 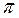 = 64; для нафталина - 56, для нитробензола - 82. Зная
= 64; для нафталина - 56, для нитробензола - 82. Зная 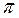 - сульфирования и массовую долю SO3 в исходной кислоте -
- сульфирования и массовую долю SO3 в исходной кислоте - 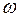 , рассчитывают необходимую для сульфирования 1 моля ароматического соединения массу кислоты по формуле
, рассчитывают необходимую для сульфирования 1 моля ароматического соединения массу кислоты по формуле
|
|
|
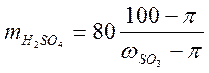
где 80 - молярная масса SO3.
Приведенная формула показывает, что для снижения расхода Н2SO4 и уменьшения количества отработанной кислоты нужно использовать более концентрированную серную кислоту. Так, при сульфировании бензола купоросным маслом 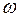 = 75%,
= 75%, 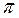 = 64. Минимальное количество купоросного масла составляет 262 г, а для реакции со 100% Н2SO4 (моногидрат)
= 64. Минимальное количество купоросного масла составляет 262 г, а для реакции со 100% Н2SO4 (моногидрат) 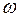 = 81,7 необходимо только 162 г. При этом получается соответственно 182 и 82 г отработанной кислоты.
= 81,7 необходимо только 162 г. При этом получается соответственно 182 и 82 г отработанной кислоты.
Реакция сульфирования протекает сравнительно медленно. Поэтому, хотя она и экзотермична (тепловой эффект 126-168 кДж/моль), ее чаще всего проводят при нагревании. Реакционная масса может быть гетерогенна, и поэтому очень важно эффективное перемешивание.
Сульфирование олеумом
Реакции ароматических соединений с олеумом протекают в две стадии. Первая стадия состоит в превращении избыточного серного ангидрида
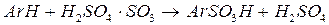
Эта реакция необратима и высоко экзотермична (180 кДж/моль) для 20%-ного олеума. Во второй стадии сульфирования участие начинает принимать серная кислота. Закономерности ее взаимодействия с ароматическими соединениями были рассмотрены выше. При использовании олеума и SO3 в отличие от сульфирования серной кислотой протекает значительно большее число реакций. Высокая активность этих агентов делает возможным вступление в ядро второй сульфогруппы по типичной схеме последовательных превращений
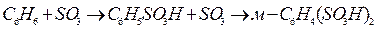
Это используют в целевом синтезе м-бензолдисульфокислоты и из нее - резорцина, когда первую стадию ведут с помощью Н2 SO4, а вторую - под действием олеума.
При сульфировании олеумом и SO3 образуется некоторое количество сульфонов
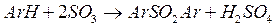
Эта реакция особенно заметна для бензола, для алкилбензолов она наблюдается в незначительной степени.
Другая побочная реакция состоит в образовании ангидридов сульфокислот, выход которых растет при избытке SO3
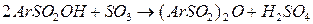
При действии небольшого количества воды можно превратить ангидриды в целевые сульфокислоты.
Сульфохлориды (сульфонилхлориды) - обычно получают сульфируя ароматические соединения хлорсульфоновой кислотой. На первом этапе реакции образуется сульфокислота.
|
|
|
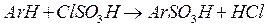
Эта стадия реакции необратима, так как вода в реакционной массе отсутствует. Далее по равновесной реакции с хлорсульфоновой кислотой образуется сульфохлорид.

Чтобы сместить это равновесие вправо, необходим избыток хлорсульфоновой кислоты. Поэтому обычно для сульфирования берут не менее 4-5 моль хлорсульфоновой кислоты на 1 моль исходного соединения (пример - синтез стрептоцида). После проведения реакции сульфомассу осторожно выливают на колотый лед или охлажденную воду, продукт реакции отделяют фильтрованием или (если он жидкий) расслаиванием. Сульфохлориды получаются также при действии PCl5 на сульфокислоты и их соли. Их используют в качестве ацилирующих агентов для получения сульфамидов, а восстановлением получают сульфиновые кислоты и тиофенолы.
Аминосульфокислоты
Аминогруппа является одним из сильнейших электронодонорных заместителей и направляет сульфогруппу в о- и n-положение. Однако, при действии серной кислоты или олеума аминогруппа протонируется, причем равновесие почти полностью смещается вправо

Протонированная аминогруппа (аммониевая) является уже сильным электроноакцепторным заместителем минимально тормозящим реакцию в мета-положении. Поэтому при прямом сульфировании аминов практически неизбежно образование изомеров, которые, как правило, с трудом разделяются. Поэтому для получения чистых индивидуальных продуктов пользуются обходными методами или применяют так называемую «реакцию запекания». Например, бисульфат анилина при этом через N-фенилсульфаминовую кислоту образует сульфаниловую кислоту - n-аминобензолсульфокислоту:
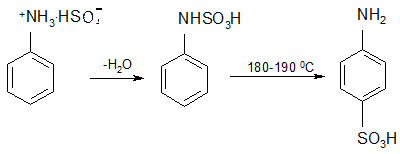 |
Эту реакцию осуществляют путем длительного нагревания заранее приготовленных сульфатов (бисульфатов) ароматических аминов при определенной температуре, обычно не превышающей 2000С. Раньше это делали на металлических противнях в специальных печах при заданной температуре. В настоящее время в промышленности бисульфаты аминов нагревают в высококипящих органических растворителях (например - полихлориды бензола). Это обеспечивает значительно более равномерный обогрев и исключает подгорание твердого продукта.
|
|
|
Лабораторная работа
«ПОЛУЧЕНИЕ п-ТОЛУОЛСУЛЬФОКИСЛОТЫ»
п-Толуолсульфокислоту применяют для синтеза п-крезола, в качестве более мягкого, чем серная кислота, кислотного катализатора, при анализе аминов и т.д. Ее получают обычно прямым сульфированием толуола серной кислотой
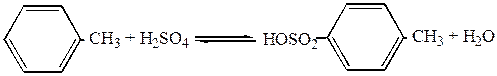
Параллельно с п-толуолсульфокислотой образуется некоторое количество о-толуолсульфокислоты, так как метильная группа является заместителем первого рода. Для предотвращения образования ди- и полисульфокислот сульфирование ведут в избытке толуола и при хорошем перемешивании реакционной массы, а для смещения равновесия реакции в сторону образования сульфокислоты реакционную воду в процессе сульфирования отгоняют в виде азеотропной смеси с толуолом.
п-Толуолсульфокислота весьма гигроскопичное вещество. Она кристаллизуется с одной молекулой воды и образует бесцветные кристаллы в виде призм, которые плавятся при 104-1050С и подвергаются гидролизу при 150 0С.
Цель работы - изучение реакции сульфирования толуола серной кислотой, выделение n-толуолсульфокислоты, определение температуры плавления, кислотного числа и составление материального баланса опыта.
|
|
|


