 |
Отсутствие гидролиза в растворах.
|
|
|
|
Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr, K2SO4, NaClO4, BaCl2, Ca(NO3)2 и др.) гидролизу не подвергаются, т.к. ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не гидролизуются также и труднорастворимые соли (CaCO3, Mg3(PO4)2 и др.) из-за очень низкой концентрации ионов в водных растворах этих солей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт №1. Определение рН водных растворов электролитов.
Цель работы: определение водородного показателя среды методами визуального колориметрирования и рН-метрии.
| № п/п | Формула соли | Окраска лакмуса | Реакция среды | рН среды | |
| Индикаторная бумага | рН - метр | ||||
| 0,1 н HCl | |||||
| 0,1 н NaOH | |||||
| 0,1 н Na2CO3 | |||||
| 0,1 н AlCl3 |
Опыт №2. Ионно-обменные реакции.
Работа с таблицей растворимости.
2а) Получение осадков соли.
Ход работы: в пробирку накапать 3 капли растворимой соли (SnCl2, AlCl3, Cr2(SO4)3, ZnSO4, Pb(NO3)2 и т.д.) и добавить 1 каплю другого растворимого вещества (выбрать самостоятельно), чтобы в результате реакции образовалась нерастворимая соль. Написать уравнения реакции в молекулярной, ионно-молекулярной и ионной формах.
Б) Получение амфотерного гидроксида и исследование его свойств.
Ход работы: получить в двух пробирках осадок гидроксида металла взаимодействием растворимой соли со щелочью: поместить по 5 капель соли в каждую пробирку и добавить по 1-2 капли (строго!) NaOH до образования осадка. Напишите уравнения реакции в молекулярной, ионно-молекулярной и ионной формах.
|
|
|
Затем в первую пробирку добавьте кислоту до полного растворения осадка (кислоту выбрать по таблице растворимости). Напишите уравнения реакции в молекулярной, ионно-молекулярной и ионной формах.
Во вторую пробирку добавьте избыток NaOH до полного растворения осадка. Напишите уравнения реакции в молекулярной, ионно-молекулярной и ионной формах. Сделайте вывод. Составьте схему диссоциации амфотерного гидроксида.
Опыт №3. Гидролиз солей.
Цель работы: опытным путем изучить реакцию гидролиза солей и смещение равновесия гидролиза.
а ) Реакция cреды в растворах различных солей.
Задание:
1.Используя нейтральный раствор лакмуса, определите реакцию cреды в растворах данных ниже солей.
2.По результатам опыта установите:
- типы солей, подвергающихся гидролизу при растворении в воде;
- реакцию среды в растворе гидролизующейся соли;
- типы солей, гидролизующихся ступенчато.
3.Напишите ионно-молекулярные и молекулярные уравнения реакций гидролиза солей.
4.Приведите определение реакции гидролиза соли.
Ход работы: В 7 пробирок до ⅓ их объема налить нейтральный раствор лакмуса. Один из растворов используйте в качестве контрольного. В остальных пробирках растворите по микрошпателю кристаллических солей в следующей последовательности: ацетат натрия, хлорид алюминия, ацетат аммония, хлорид натрия, карбонат аммония, карбонат натрия. Растворы тщательно перемешайте стеклянными палочками (каждый раствор отдельной палочкой) и сравните окраски их с окраской контрольного раствора. Результаты наблюдений запишите в ниже следующую таблицу.
Реакция среды в растворах различных солей и склонность их к гидролизу
| Формула соли | Тип соли, соль образуют | Гидролиз | Вид гидролиза | pH p-pa | ||
| основ. | кислота | по Ktn+ | по Anm- | |||
| (сила электролита) | ||||||
| СH3COONa | сильное (NaOH) | слабая CH3COOH | - | СH3COO- | простой | >7 |
|
|
|
Сформулируйте выводы по пунктам 2 и 4 задания. Выполните пункт 3 задания.
Б) Влияние температуры на равновесие гидролиза соли.
Цель опыта: Экспериментально установить влияние температуры на равновесие в растворе гидролизующейся соли.
Ход работы: В пробирку наполовину объема налейте 1 н раствор ацетата натрия и добавьте 2-3 капли фенолфталеина. Объясните окрашивание раствора (в какой цвет?), составив ионно-молекулярное уравнение реакции гидролиза данной соли. Разделите раствор на две части и одну из пробирок нагрейте. Как изменилась окраска раствора? В каком направлении сместилось равновесие гидролиза соли при повышении температуры? Охладите пробирку током водопроводной воды. Что происходит с окраской раствора? В какую сторону сместилось равновесие гидролиза? Результаты опыта сведите в таблицу:
Смещение равновесия гидролиза при изменении температуры
Ионно-молекулярное уравнение гидролиза СН3 СОО Na:
СН3 СОО- + НОН <== > CH3COOH + OH-
| Изменение температуры | Изменение окраски раствора | Направление смещения равновесия | Изменение сте- пени гидролиза |
| Повышение | |||
| Понижение |
Сделайте вывод о влиянии температуры на степень гидролиза соли. Определите, экзо-, или эндотермична реакция гидролиза соли (ответ мотивируйте на основе принципа Ле Шателье).
Лабораторная работа №9
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ МЕТОДОМ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
(Глинка Н.Л.,2000, глава 37, Коровин Н.В., 2000, §12.3)
Теоретические сведения.
Жесткость воды обусловлена содержанием в ней растворимых солей кальция и магния, гидрокарбонатов, хлоридов и сульфатов. Различают временную и постоянную жесткость воды. Временная жесткость определяется содержанием в воде растворимых гидрокарбонатов кальция и магния. При кипячении воды гидрокарбонаты переходят в малорастворимые карбонаты:
Ca(HCO3)2 = CaCO3 ¯ + CO2 + H2O
Mg(HCO3)2 = Mg(OH)2¯ + 2CO2
Карбонатную жесткость также можно удалить химическими способами, например, известкованием:
Ca(HCO3)2 + Ca(OH)2 = CaCO3 ¯+ 2H2O
Таким образом временная жесткость устраняется.
|
|
|
Постоянная (некарбонатная) жесткость обусловлена присутствием в воде хлоридов и сульфатов кальция и магния. Некарбонатную жесткость можно удалить химическими способами:
CaCl2 + Na2CO3 = CaCO3 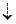 +2NaCl
+2NaCl 
Сумма временной и постоянной жесткости составляет общую жесткость. Выражается жесткость в миллимоль эквивалентных ионов Ca+2 и Mg+2 на литр воды.
Вода с жесткостью менее 4 ммоль-экв/л называется мягкой, от 4 до 8 - средней и от 8 до 12 - жесткой.
В настоящее время жесткость воды определяют комплексонометрическим методом с применением реактива Na2H2Y.2H2O двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты) - Комплексона III или Трилона Б.
| Трилон Б имеет следующую структуру: | 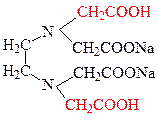
|
| Гексадентатный комплекс Комплексоны являются лигандами и образуют со многими катионами комплексы. Например, в нашем случае, с катионом Са+2 образуется следующий комплекс: | 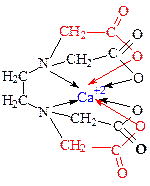
|
Реакция взаимодействия катиона с ЭДТА в растворе можно представить уравнением:
Ca+2 + H2Y2- = 2H+ + CaY2-
где Y2- - анион ЭДТА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порядок выполнения работы
1. Заполнить бюретку раствором Трилона Б с концентрацией 0.025 моль-экв/л.
2. Взять пипеткой пробу воды 50 мл и поместить в коническую колбу. Добавить в воду 1 мл аммиачного буферного раствора (NH4OH + NH4Cl), для поддержания рН в интервале 9-10, и на кончике шпателя немного сухого индикатора "Эриохром черный".
3. Титровать воду раствором Трилона Б до изменения окраски с красно-фиолетовой в синюю. Отметить объем Трилона Б по бюретке.
4. Результаты титрования занести в таблицу:
| № п/п | Объем воды, мл
V 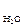
| Объем Трилона Б, мл Vтр | Концентрация трилона Б, моль-экв/л |
| 0.025 | |||
| 0.025 | |||
| 0.025 | |||
| Среднее значение | 0.025 |
5. Расчет жесткости воды:
V 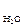 . CH
. CH 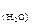 = Vтр . Cн(тр)
= Vтр . Cн(тр)
CH( 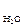 ) =
) = 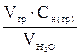
где V(тр) и V 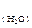 - объем растворов в мл, С
- объем растворов в мл, С 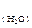 - концентрация ионов Са2+ и Mg 2+ в воде (ммоль-экв/л), Cн(тр) - концентрация трилона Б моль-экв/л.
- концентрация ионов Са2+ и Mg 2+ в воде (ммоль-экв/л), Cн(тр) - концентрация трилона Б моль-экв/л.
Жесткость воды в баллах:
Ж = Сн 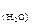 . 1000 ммоль- экв/л H2O
. 1000 ммоль- экв/л H2O
6. Зарисовать бюретку, пипетку и коническую колбу.
7. Сделать вывод.
Лабораторная работа №10
|
|
|
Окислительно-восстановительные реакции
(Глинка Н.Л.,2000, 9.1-9.3, Коровин Н.В., 2000, §9.1)
Цель работы: опытным путем изучить окислительно-восстановительные реакции и установить:
а) зависимость окислительно-восстановительных свойств вещества от степени окисления атома в молекуле;
б) влияние реакции среды на характер протекания окислительно-восстановительных реакций;
в) выработать навыки составления уравнений окислительно-восстановительных реакций методом электронного баланса.
Теоретические сведения.
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например: N2H4 (гидразин)
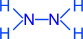
степень окисления азота – -2; валентность азота – 3.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме O+2F2-1 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
|
|
|


