 |
Опыт №4. Влияние температуры на скорость химической реакции в гомогенной системе.
|
|
|
|
Для выполнения опыта используется термостат – стакан с крышкой, в котором имеются три отверстия для термометра и двух пробирок.
Выполнение работы: три термостата наполнить на 2/3 водой, температура которых должна отличаться на 10 ОС и оставаться постоянной в течение опыта.
В каждый термостат вставить термометр и 2 пробирки. В первую пробирку налить 10 капель 1 н. раствора Na2S2O3, во вторую пробирку –10-15 капель 2 н. раствора H2SO4 и опустить в него пипетку.
Через 5 минут включить секундомер и не вынимая пробирку с тиосульфатом натрия из термостата №1, добавить в нее 1 каплю 2 н. раствора H2SO4, находящейся в том же термостате. Считая по секундомеру, измерить время от момента добавления кислоты до появления заметной опалесценции. Результат занести в таблицу. Повторить опыт с растворами тиосульфата натрия и серной кислоты в термостатах №2 и №3. Произвести отсчет времени реакции по секундомеру, как и в первом случае.
Запись данных опыта:
1. Результаты занести в таблицу.
| № опыта | Температура опыта, оС | τ, сек | W=1/τ |
| t1 | |||
| t2 | |||
| t3 |
2. Рассчитайте температурный коэффициент по формуле:
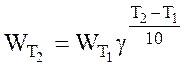
5. Сделайте вывод о зависимости скорости химической реакции от температуры.
Лабораторная работа №5
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
(Глинка Н.Л., 2000, 6.2.8-6.2.9, Коровин Н.В., 2000, §5.5)
Цель работы: опытным путем установить влияние на состояние химического равновесия:
- изменения концентрации веществ;
- изменения температуры.
Теоретические сведения.
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции  равна скорости обратной реакции
равна скорости обратной реакции  . Равенство
. Равенство  является кинетическим условием химического равновесия.
является кинетическим условием химического равновесия.
|
|
|
Химическое равновесие характеризуется постоянством величин энергии Гиббса системы GT. Равенство ΔGT = 0 является термодинамическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам, называется константой равновесия. Для обратимой реакции
Н2(г) + I2(г)↔2HI(г)
константа равновесия имеет вид:
 или
или  ,
,
где КС, КР – константы равновесия в случае отношения молярных концентраций и парциальных давлений соответственно; [HI], [H2], [I2] – равновесные молярные концентрации;  ,
,  - парциальные давления.
- парциальные давления.
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в сиcтеме. Показывает на сколько скорость прямой реакции больше скорости обратной; характеризует глубину протекания процесса.
Константа равновесия связана со стандартной энергией Гиббса данной реакции ( ) следующим соотношением:
) следующим соотношением:
 = -RTlnKС
= -RTlnKС
где R — универсальная газовая постоянная [8,31 Дж/(моль.К)]; Т — абсолютная температура, К; КС — константа равновесия.
Если КС>1 (ΔG<0), то в равновесной системе преобладают продукты реакции, а если КС<1 (ΔG>0), то в равновесной системе преобладают исходные вещества.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры (p,T,CM), при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
|
|
|
В общем случае, направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону, противодействующую этому воздействию.
1. При увеличении концентрации реагирующих веществ, равновесие сместится в сторону продуктов реакции, а при уменьшении концентрации исходных веществ – в сторону их образования.
2. При увеличении общего давления в системе равновесие смещается в сторону меньшего числа моль газообразных веществ, а при уменьшении – в сторону большего числа моль газообразных веществ.
3. Увеличение температуры в системе смещает равновесие в сторону эндотермической реакции, а уменьшение – в сторону экзотермической реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Влияние изменения концентрации веществ на химическое равновесие.
Задание: изучить влияние изменения концентрации веществ на химическое равновесие в системе:
FeCl3 + 3KSCN ⇄ Fe(SCN)3 + 3KCl красныйРоданид железа (III) Fe(SCN)3 придает раствору ярко красную окраску, раствор хлорида железа(III) окрашен в желтый цвет, а растворы роданида и хлорида калия бесцветны. Поэтому изменение интенсивности окраски позволяет судить об изменении концентрации Fe(SCN)3, т.е. о направлении сдвига равновесия в реакционной системе.
Выполнение опыта.
1. В пробирку налейте на 3/4 объема дистиллированной воды и добавьте по 1-2 капли насыщенных растворов хлорида железа (III) и роданида калия.
2. Разлейте приготовленный раствор поровну в четыре пробирки и первую пробирку оставьте для контроля.
3. В вторую пробирку добавьте одну каплю насыщенного раствора хлорида железа (III), в третью – 1 каплю насыщенного раствора роданида калия, а в четвертую - микрошпатель хлорида калия.
4. Перемешайте растворы (встряхиванием или стеклянной палочкой) и сравните интенсивность окраски растворов с интенсивностью окраски контрольного раствора.
5. Результаты наблюдений запишите в таблицу.
| № | Добавленный реактив | Изменение интенсивности окраски | Направление сдвига равновесия |
| Контрольная | |||
| FeCl3 (нас.) | |||
| KSCN (нас.) | |||
| KCl |
|
|
|
Запись данных опыта:
1. Какие вещества находятся в равновесии?
2. Напишите выражение константы химического равновесия для исследуемой системы.
3. Исходя из того, что при данной температуре константа равновесия постоянна, объясните наблюдаемые изменения интенсивности окраски растворов.
4. Сформулируйте вывод о влиянии изменения концентрации веществ в реакционной системе на направление сдвига равновесия.
Опыт 2. Влияние температуры на химическое равновесие
Задание: изучить влияние изменения температуры на состояние химического равновесия в системе крахмал - йод:
(C6Н11О5)n+xJ2<==>(C6H11O5)n·xJ2б/цв. желтый синийВыполнение опыта.
1. В две пробирки налейте 3-4 мл. раствора крахмала и добавьте по несколько капель 0,1М раствора йода (до появления синей окраски).
2. Одну из пробирок оставьте в качестве контрольной. Другую - осторожно нагрейте на водяной бане. Наблюдайте изменение окраски.
3. Охладите пробирку водой из-под крана. Как изменяется окраска раствора?
4. Результаты наблюдений напишите в таблицу.
| Изменение температуры | Изменение интесивности окраски раствора | Направление смещения равновесия |
| Контроль | ||
| Нагревание | ||
| Охлаждение |
Запись данных опыта:
1. По результатам наблюдений на основе принципа Ле Шателье определите - экзотермической или эндотермической является прямая реакция.
2. Сформулируйте общий вывод о влиянии изменения температуры на направление сдвига равновесия.
Лабораторная работа №6
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ РАСТВОРЕННОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ.
(Глинка Н.Л.,2000, 7.1-7.2, Коровин Н.В.,2000, §8.1)
Цель работы: определить методом криоскопии молекулярную массу растворенного вещества.
Теоретические сведения
Криоскопическим называется метод определения молекулярной массы по понижению точки замерзания растворителя. Для исследования этого метода необходимо вспомнить закон Рауля применительно к разбавленным растворам. Мы знаем, что давление насыщенного пара каждой жидкости есть величина постоянная для данной температуры. При растворении в жидкости какого-либо нелетучего вещества давление пара жидкости понижается. Таким образом, давление пара раствора всегда ниже давления пара чистого растворителя при той же температуре. Разность между числовыми значениями давления пара чистого растворителя и давления пара раствора называется обычно понижением давления пара растворителя над раствором. Это можно выразить формулой:
|
|
|

В 1887 году французский физик Рауль на основании многочисленных опытов с растворами различных твёрдых веществ и нелетучих жидкостей установил следующий закон: относительное понижение давления насыщенного пара над раствором по сравнению с чистым растворителем прямо пропорционально мольной доле растворённого вещества.
Зависимость между понижением давления пара и количеством растворённого вещества может быть выражена в математической форме. Обозначим давление чистого растворителя через pо, понижение давления пара через  , число молей растворённого вещества через n1 и число молей растворителя через n2. Тогда закон Рауля для разбавленных растворов выразится уравнением:
, число молей растворённого вещества через n1 и число молей растворителя через n2. Тогда закон Рауля для разбавленных растворов выразится уравнением:

Измерением понижение давления пара раствора можно пользоваться для определения молекулярной массы растворённых веществ. Однако на практике обычно применяется другой, более удобный метод, основанный на измерении понижения температуры замерзания или повышения температуры кипения раствора.
Все чистые вещества характеризуются строго определённой температурой замерзания. Так, чистая вода при нормальном атмосферном давлении замерзает при 0ºС, бензол при +5,5ºС. Эти температуры сохраняются неизменными до тех пор, пока вся жидкость не замёрзнет или не превратится в пар.
Иначе обстоит дело с растворами. Присутствие растворённого вещества понижает точку (или температуру) замерзания растворителя (повышает температуру кипения), и тем сильнее, чем концентрированнее раствор. Поэтому растворы замерзают при более низких температурах, чем чистые растворители, а кипят – при более высоких температурах.
 ,
,

Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны моляльной концентрации раствора:
 ,
,
 ,
,
где Сm – моляльная концентрация; E и K – эбулиоскопическая и криоскопическая постоянные [(˚С·кг)/моль], зависящие только от природы растворителя и не зависящие от природы растворенного вещества.
Эбулиоскопическая постоянная показывает на сколько повысится температура кипения раствора, если в 1 кг растворителя растворить 1 моль вещества. Криоскопическая постоянная показывает на сколько понизится температура замерзания раствора, если в 1 кг растворителя растворить 1 моль вещества.
|
|
|
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный раствор "А": 20%,  =0.97 г/см3
=0.97 г/см3
Заданные растворы: С1 = 5%, C2 = 6%, C3 = 7%

| ||
| Рис.4. Схема установки (криостата): | ||
| 1 - Стакан | ||
| 2 - Пробка | ||
| 3 - Пробирка | ||
| 4 - Термометр | ||
| 5 - Холодильная смесь | ||
| 6 - Заданный раствор | ||
Ход работы:
1. Приготовить 10 г заданного раствора.
Для этого, рассчитайте объем 20%-го раствора "A" и объем дистиллированной воды, необходимые для приготовления заданного раствора.
2. Заполнить приготовленным раствором пробирку так, чтобы шарик термометра был полностью погружен в раствор (смотри рисунок).
3. Заполнить стакан (криостат) холодильной смесью (на 100 г снега или льда - 29 г NH4Cl + 16 г KNO3).
4. Перемешивая раствор термометром*, произвести измерение температуры замерзания, для чего:
· Произвести замеры при понижении температуры до момента появления первых кристаллов льда в пробирке.
· Занести в таблицу величину температуры кристаллизации.
· Продолжить замеры температуры при уменьшении ее ниже точки кристаллизации. Снимать показания с термометра через каждые 30 секунд. Результаты занести в таблицу.
| τ,мин | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | |
| t,oC |
5. Если опыт не получился, то вынуть пробирку из криостата, нагреть ее до растворения кристаллов и сделать повторное измерение температуры замерзания согласно п.5.
6. Зарисовать график зависимости t(oC)-τ(мин). Подобрать масштаб таким образом, чтобы график получился красивым.
7. Произвести расчет:
 , ,
| где Сm - моляльная концентрация раствора, моль/кг |
 , ,
| где К - криоскопическая константа (справочная величина), К=1.86 |

| где mр.в-ва= (w. mр-ра)/100 % mр-ля = mр-ра - mр.в-ва |

|
8. Сделать вывод.
*) Перемешивание необходимо для того, чтобы не попасть в область метастабильного состояния (см. Рис.4 точка А)
Возможные виды криоскопических кривых
 Рис.2 Рис.2
|  Рис.3 Рис.3
|  Рис.4 Рис.4
|
Лабораторная работа №7
КОЛЛОИДНЫЕ РАСТВОРЫ
(Глинка Н.Л., 2000, глава 10, Коровин Н.В., 2000, §6.3, §8.7)
Цель работы: знакомство с методами получения коллоидных растворов и их свойствами.
Теоретическая часть:
Коллоидными растворами называют растворы, в которых линейные размеры частиц дисперсной фазы лежат в пределах от 1 до100 нм.
Коллоидные растворы (золи) являются гетерогенными. Они состоят из сплошной непрерывной фазы – дисперсионной среды и, находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсионной среды.
Коллоидная дисперсность вещества является промежуточной между грубой дисперсностью, характерной для взвесей, и молекулярной, характерной для истинных растворов. Поэтому коллоидные растворы получают либо из истинных растворов путем укрупнения частиц молекулярной дисперсности до определенного предела (максимум до 100 нм), либо из взвесей путем дробления грубодисперсных частиц также до определенного предела (минимум до 1 нм). В этой связи различают конденсационные методы (укрупнение частиц) и методы диспергирования (дробление частиц).
Дисперсная фаза в коллоидном растворе (или золе) представлена коллоидными частицами, в состав которых входят ядро, зарядообразующие ионы и противоионы. Зарядообразующие ионы могут быть положительно или отрицательно заряженными. Поэтому и коллоидные частицы имеют либо положительный, либо отрицательный заряд. Заряженная коллоидная частица притягивает к себе молекулы H2O из дисперсионной среды; так создается гидратная оболочка, окружающая коллоидную частицу.
Структурной единицей коллоидного раствора считают мицеллу.
Строение мицеллы:

 ядро противоионы адсорбционного слоя
ядро противоионы адсорбционного слоя
64748 64748
AgI {[m(AgI) nAg+ (n-x)NO3-]x+xNO3-}0
золь 123 -потенциалопределяющие ионы
14444244443 123
коллоидная частица противоионы
диффузного слоя
мицелла
Коллоидные растворы обладают специфическими оптическими, кинетическими и электрическими свойствами (специфика связаны с размерами и зарядом коллоидных частиц) и характеризуются высокой кинетической и агрегативной устойчивостью. Первая является следствием кинетических свойств золей и проявляется в том, что концентрация коллоидных растворов одинакова по всему объему системы и при правильном хранении не изменяется во времени, а вторая – в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются, не слипаются. Сохранение коллоидной степени дисперсности во времени обусловлено прежде всего наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание.
Устойчивость коллоидного раствора можно нарушить. Потеря агрегативной устойчивости золя приводит к укрупнению частиц дисперсной фазы за счет их слипания. Этот процесс называют коагуляцией. Коагуляция вызывает нарушение кинетической устойчивости системы, которое приводит к образованию осадка (коагулята). Этот процесс называют седиментацией.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Образование геля кремниевой кислоты
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
Выполнение работы:
а) Получение золя кремниевой кислоты
В пробирку внесите 6 капель 2 н раствора соляной кислоты и добавьте, встряхивая пробирку, 15 капель 10%-го раствора силиката натрия. Образуется золь кремниевой кислоты, который постепенно застудневает с образованием геля.
б) Коагуляция гидрозолей при нагревании
Нагрейте полученный золь кремниевой кислоты. Наблюдайте образование студенистой массы, не выливающейся при перевертывании пробирки вверх дном - геля кремниевой кислоты.
Запись данных опыта.
Чем объясняется образование студней и в каких случаях это явление имеет место? Что такое гель? Объясните схему процесса образования геля, его структуру. Почему нагревание способствует коагуляции золей? Составьте формулу мицеллы золя кремниевой кислоты. Объясните механизм образования геля.
Опыт 2. Получение гидрозоля берлинской лазури методом пептизации.
Для получения данного золя используется реакция обмена:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
Выполнение работы:
а) Получение осадка берлинской лазури.
Сливают в пробирке приблизительно 1 мл 0,05 М раствора FeCl3 и 1 мл насыщенного раствора K4[Fe(CN)6], полученный осадок берлинской лазури отфильтровывают и промывают на фильтре дистиллированной водой до удаления избытка K4[Fe(CN)6].
б) Пептизация осадка берлинской лазури.
К оставшемуся на фильтре промытому осадку добавляют 2-3 мл раствора щавелевой кислоты. Фильтрат собирают в пробирку.
Запись данных опыта.
Сформулируйте сущность метода получения гидрозоля. Каким образом исходная концентрация влияет на получение коллоидных систем? Какой процесс называется пептизацией? Что является пептизатором в данном опыте?
Опыт 3. Получение гидрозолей берлинской лазури с разноименными зарядами частиц
Для получения данных золей используется реакция обмена:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
В результате реакции образуется золь мало растворимого в воде вещества Fe4[Fe(CN)6]3 - берлинской лазури.
Реактивы: в работе используются 0,005 н раствор FeCl3 и 0,005 н раствор гексацианоферрата (II) калия K4[Fe(CN)6].
3.1 Приготовление золя берлинской лазури при избытке FeCl3
К 3 мл раствора FeCl3 прилейте 1 мл раствора K4[Fe(CN)6], перемешайте раствор. Образуется золь берлинской лазури.
Что собой представляет золь? Укажите фазовый состав полученного золя. Составьте формулу мицеллы и укажите знак заряда гранулы.
3.2 Приготовление золя берлинской лазури при избытке K4[Fe(CN)6]
К 3 мл раствора K4[Fe(CN)6] прилейте 1 мл раствора FeCl3. Определите фазовый состав полученного золя, заряд частиц золя. Составьте формулу мицеллы.
Запись данных опыта.
1) Что такое золь?
2) Какие вещества могут образовывать золи в водной среде (гидрозоли) и при каких условиях?
3) Чем определяется знак заряда частиц золя?
4) Какие химические реакции предшествуют образованию мицелл?
5) Какие электролиты являются стабилизаторами 1-го и 2-го золей?
6) Каков ионный состав интермицеллярной жидкости при получении 1-го и 2-го золей?
7) Напишите возможные формулы мицелл, используя правило Фаянса-Панета.
|
|
|


