 |
Схема гальванического элемента
|
|
|
|
ē




(-) А: Zn | ZnSO4 | | CuSO4 | Cu:К (+)
Процессы, протекающие на электродах:
(-) A: Zn0 – 2 e- 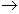 Zn2+
Zn2+
(+) K: Cu2+ +2 e- 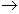 Cu0.
Cu0.
Zn0 + Cu2+ 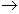 Zn2+ + Cu0 - уравнение токообразующей реакции в ионной форме
Zn2+ + Cu0 - уравнение токообразующей реакции в ионной форме
Zn+CuSO4 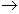 ZnSO4+Cu - уравнение токообразующей реакции в молекулярной форме
ZnSO4+Cu - уравнение токообразующей реакции в молекулярной форме
Лабораторная работа №12
КОРРОЗИЯ МЕТАЛЛОВ
(Глинка Н.Л., 2000, 38.5, Коровин Н.В., 2000, глава 10.)
Цель работы: опытным путем изучить процессы химической и электрохимической коррозии металлов; факторы, влияющие на скорость коррозии металлов.
Теоретические сведения
Коррозия – это процесс самопроизвольного разрушения металла под воздействием окружающей среды. В зависимости от механизма протекающих процессов различают химическую и электрохимическую коррозию.
Химическая коррозия происходит под воздействием сухих газов или жидкостей, не проводящих электрический ток.
Электрохимическая коррозия происходит при контакте металлических поверхностей с растворами электролитов и сопровождается возникновением электрического тока.
При соприкосновении металла с электролитом на его поверхности возникает множество микрогальванических пар. При этом анодами являются частицы металла, катодами – загрязнения, примеси и, вообще, участки металла, имеющие более положительное значение электродного потенциала.
В атмосферных условиях роль электролита играет водная пленка, в которой могут быть растворены газы CO2, SO2, H2S, O2. При контакте двух металлов в среде электролита роль анода выполняет более активный металл, который и корродирует. Катодный же процесс зависит от рН среды.
Пример 1. Железо в контакте с медью в кислой среде (рН<7).


 Подобные процессы протекают в системах водяного охлаждения тепловозов, где медные трубки холодильников контактируют с чугунными крышками охлаждающих секций. Образуется гальванический элемент, схема и электродные процессы которого представлены следующим образом:
Подобные процессы протекают в системах водяного охлаждения тепловозов, где медные трубки холодильников контактируют с чугунными крышками охлаждающих секций. Образуется гальванический элемент, схема и электродные процессы которого представлены следующим образом:
|
|
|
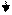 ē
ē
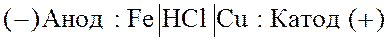
(-) Анод: Fe0 – 2e- 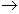 Fe2+
Fe2+
(+)Катод: 2 Н+ + 2e- 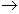 Н2
Н2
Fe0 + 2Н+ 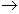 Fe2+ + Н2
Fe2+ + Н2
Fe0 + 2НСI 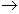 FeСI2 + Н2
FeСI2 + Н2
Железо (анод) разрушается, на катоде выделяется газообразный водород – коррозия с водородной деполяризацией катода.
Пример 2. Железо в контакте с медью в щелочной или нейтральной среде (pH≥7). Схему гальванического элемента и электродные процессы, протекающие в нем, можно представить:


 ē
ē

(-)Анод: 2Fe0 -2ē ® 2Fe+2
(+)Катод: О2 + 2Н2О +4ē ® 4ОН-
2Fe + O2 +2H2O = 2Fe(OH)2
4Fe(OH)2 + O2 +2H2O® 4Fe(OH)3 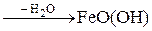 -ржавчина
-ржавчина
Железо (анод) разрушается, на катоде восстанавливается кислород, растворенный в воде – коррозия с кислородной деполяризацией катода.
Скорость коррозии тем больше, чем дальше находятся друг от друга в ряду напряжения металлы, из которых образована гальваническая пара.
Коррозию металла можно затормозить пассивацией и изменением потенциала металла, уменьшением концентрации окислителя, изоляцией поверхности металла от окислителя и пр. Все эти способы защиты можно объединить в группы:
1) защитные покрытия металлов;
2) обработка коррозионной среды;
3) электрохимические методы защиты;
4) получение коррозионно-стойких сплавов.
Рассмотрим первые два способа.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
Металлические покрытия по характеру защитного действия подразделяются на катодные и анодные.
К анодным относятся такие покрытия, в которых металл покрытия имеет более отрицательное значение электродного потенциала, чем защищаемая деталь. Например, железо, покрытое цинком. При катодном покрытии металл покрытия имеет более положительное значение электродного потенциала, чем сама деталь. Например, железо, покрытое медью или оловом (луженое железо). Пока защитный слой не нарушен, принципиального различия между этими покрытиями нет.
|
|
|
При нарушении целостности катодное покрытие перестает защищать основной металл от коррозии, создавая с ним гальваническую пару, усиливает его коррозию. Анодное же покрытие будет само подвергаться разрушению, защищая тем самым основной металл.
Метод обработки коррозионной среды пригоден для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Например, скорость процессов кислотной коррозии может быть значительно снижена введением в кислоту ингибиторов – веществ, замедляющих коррозию, в количестве 0,1, 0,5%.
Механизм действия ингибиторов заключается в том, что, адсорбируясь на поверхности металла, они подавляют действие коррозионных микропар, препятствуя катодному или анодному процессу или обоим вместе.
Электрохимический метод защиты основан на торможении анодных или катодных реакций за счет изменения потенциала этих реакций. Одним из электрохимических методов является протекторная защита. Сущность его заключается в том, что к защищаемой конструкции присоединяют протектор, то есть металл, имеющий более отрицательный электродный потенциал. В искусственно созданной корррозионной гальванической паре разрушается протектор, то есть анод, а основной металл сохраняется.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Качественная реакция на ион Fe2+.
При коррозии металлического железа его атомы теряют электроны и превращаются в ионы двухвалентного железа Fe2+. Присутствие в системе с корродирующим железом ионов Fe2+ определяют по характерной синей окраске турнбулевой сини, образующейся по реакции:
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯
Турнбулева синь
Опыт 2. Коррозия оцинкованного (Fe-Zn) и луженого (Fe-Sn) железа в кислой среде.
Выполнение работы. В две пробирки налейте на ½ их объема дистиллированной воды, добавьте в каждую по 3 капли 2н раствора серной кислоты и по 2 капли К3[Fe(CN)6].
Поместите в пробирки пластинки оцинкованного и луженого железа. Через несколько минут наблюдайте появление синего окрашивания в одной из пробирок (в какой?).
|
|
|
Запись данных опыта. Составьте схемы гальванических элементов, образующихся при повреждении защитного покрытия на оцинкованном и луженом железе. Пользуясь значениями стандартных электродных потенциалов, определите анод и катод в каждом из гальванических элементов.
Составьте уравнение анодного процесса и процесса катодной деполяризации. Какой вид электрохимической коррозии наблюдается? Какой металл выполняет роль анодного, какой - катодного защитного покрытия по отношению к железу?
Опыт 3. Зависимость скорости коррозии железа от рН среды.
Выполнение работы В пять пробирок налейте на ½ их объема следующих растворов: в первую - хлорида натрия (рН 7); во вторую - хлорида натрия и две капли 2н раствора NaOH (pH 12); в третью- дистиллированной воды и 2 капли 2н серной кислоты (рН 2); в четвертую - дистиллированной воды (рН 5); в пятую - водопроводной воды (рН определите по универсальной индикаторной бумаге). Во все пробирки добавьте по 2 капли раствора К3[Fe(CN)6] и опустите в каждую гвоздь.
Запись данных опыта. Отмечайте последовательность появления синего окрашивания турнбулевой сини в пробирках. Результаты наблюдений запишите в таблицу:
|
|
|


