 |
3.3.6.б.Специфический кислотный или основной катализ
|
|
|
|
3. 3. 6. б. Специфический кислотный или основной катализ
Между атомами электроотрицательных элементов (O, N и др. ) перенос протона происходит очень быстро (см. разд. 2. 3. 2, гл. 2); поэтому во многих реакциях вначале устанавливается равновесие между реагентом R и его сопряженной кислотой RH+, а затем RH+ в лимитирующей скорость стадии образует продукт P. В случае водных растворов
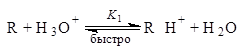

Применяя принцип стационарности, получаем
скорость = К1к2[R][H3O+].
Такая кинетика характерна, например, для гидролиза эфиров карбоновых кислот RCOOR в кислой среде. Протон, захваченный на первой стадии, возвращается в среду на второй стадии, и, следовательно, концентрация [H3O+] в ходе реакции остается постоянной. По этой причине [H3O+] можно исключить из выражения для скорости, и тогда получится уравнение реакции псевдопервого порядка, в которое не входит концентрация катализатора [H3O+]:
скорость = К1к2[R]
Тем не менее катализ легко обнаружить, если изучать кинетику при разных рН; тогда мы найдем, что константа скорости реакции псевдопервого порядка увеличивается пропорционально увеличению [H3O+] (рис. 3. 9).
Если скорость реакции пропорциональна только концентрации [H3O+] (т. е. обратно пропорциональна рН), то такой случай называется специфическим кислотным катализом. В неводных средах специфический кислотный катализ осуществляется молекулами протонированного растворителя, например, NH4+ в жидком аммиаке, СН3СООН2+ в уксусной кислоте, H3SO4+ в 100%-ной H2SO4 и т. д. Кислота, сопряженная нейтральной молекуле растворителя, называется ионом лиония; следовательно, специфический кислотный катализ - это катализ ионами лиония.
Аналогично, если скорость реакции пропорциональна только концентрации гидроксильных ионов [OH-] (т. е. рН), то это означает, что наблюдается специфический основной катализ. С точки зрения механизма реакция, специфический основной катализ означает, что реакция начинается с быстрого отрыва протона от реагента гидроксильным ионом:
|
|
|

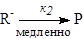
скорость = К1к2[RН][ОH-].
Примером такой реакции является альдольная конденсация:
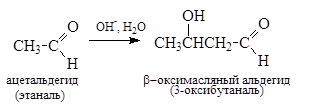
Основание, сопряженное нейтральной молекуле протонного растворителя, называется лиатным ионом; следовательно, специфический основной катализ - это катализ лиатным ионом (например, СН3О- в СН3ОН, димсиланионом CH3SOCH2- в ДМСО и т. д. ).
3. 3. 6. в. Общий кислотный и общий основной катализ
Скорость реакций, катализируемых кислотами и основаниями, не во всех случаях контролируется только значением рН раствора. Например, гидролиз этилового эфира ортоуксусной кислоты в мягких условиях можно остановить на стадии этилацетата:

Эта реакция катализируется кислотами, но не катализируется основаниями. В мета-нитрофенолятном буферном растворе при фиксированном значении рН скорость реакции не постоянна, а увеличивается при концентрации буфера*. Это означает, что кроме Н3О+ реакция катализируется также недиссоциированным мета-нитрофенолом (АН). Общая скорость, таким образом, является суммой скоростей параллельных реакций, одна из которых катализируется Н3О+, другая АН, а третья, " некаталитическая", реакция на самом деле катализируется самой водой:

В данном случае к1=2, 1. 104, к2=1, 7. 10-3 и к3=10-7 л/моль. с.
Рассмотренная реакция является примером общего кислотного катализа, который характеризуется тем, что катализатором является любая кислота (мета-нитрофенол, вода), присутствующая в растворе, а не только сопряженная кислота растворителя (Н3О+). Наблюдаемая константа скорости в случае общего кислотного катализа, таким образом, определяется выражением
|
|
|
кнабл= 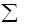 кi[HAi].
кi[HAi].
Аналогично, общий основной катализ описывается уравнением
кнабл= 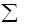 кi[Вi],
кi[Вi],
где Вi - каждое конкретное основание, содержащееся в растворе. Примером такой реакции является гидролиз уксусного ангидрида в водном ацетатном буфере:
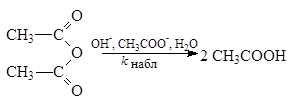
Общий кислотный катализ обычно проявляется в том случае, когда перенос протона между субстратом и основанием является медленным процессом. Как правило, это характерно для СН-кислот и С-оснований (см. разд. 3. 5. 1). Рассмотрим несколько хорошо исследованных примеров.
Известно, что образование енолят-анионов, например, из ацетальдегида является медленным процессом:

Это приводит к кинетическому уравнению
скорость=кi[RH][Вi],
где RH - органический субстрат, в данном случае ацетальдегид, являющийся СН-кислотой. Если в растворе содержится несколько оснований Вi, то каждое из них катализирует реакцию путем отщепления протона от RH с собственной скоростью. Общая скорость реакции будет суммой скоростей этих отдельных реакций.
В кислотном гидролизе виниловых эфиров медленной стадией является присоединение протона по двойной связи, т. е. С-протонирование:

В этом случае действует общий кислотный катализ.
При енолизации ацетальдегида в буферных растворах сначала происходит быстрое протонирование по кислороду, а затем медленный перенос протона от углерода к основанию Аi-:
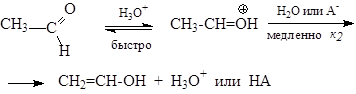
В этом случае
скорость=к1к2[R][H3O+][Аi-].
Поскольку константа диссоциации 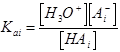 ,
,
скорость=КaiК1к2[R][АiН]. (3. 22)
Это уравнение отражает общий кислотный катализ кислотой АiН. На первый взгляд кажется довольно странным, что реакция, медленной стадией которой является атака основанием, катализируется кислотой. Однако концентрация [АiН] связана с концентрацией как [H3O+], так и [Аi-], т. е. увеличение [АiН] приводит к увеличению [H3O+], а также [Аi-] (и следовательно [RН]). Такой тип реакции называется общеосновным-специфически-кислотным катализом. Соответствующий механизм для общего основного катализа называется общекилотным-специфически-основным катализом:

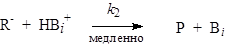
скорость=КbiК1к2[RH][Bi].
В некоторых случаях реакции имеют механизм, по кинетическому уравнению похожий на общий кислотный катализ, но без полного переноса протона от кислоты к субстрату. Реакция может ускоряться просто образованием водородной связи между R и АiН:
|
|
|
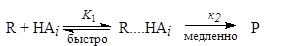
скорость=К1к2[R][АiН].
Комплексы, подобные В... НАi могут образовываться не только с кислотами Бренстеда, но и с кислотами Льюиса, т. е. реакции могут катализироваться не только протоном, но и ионами металлов. Например, щавелевоуксусная кислота склонна к реакции декарбоксилирования:

Эта реакция идет через анион кислоты и катализируется ионом Al3+; при этом образуется комплекс, в котором разрыв связи С-С облегчен поляризующим действием иона алюминия:

Кислотно-основные реакции являются причиной каталитического действия многих ферментов. Так, химотрипсины катализируют гидролиз сложных эфиров и амидов в нейтральной среде. В этой реакции осуществляется внутримолекулярных общий кислотный и основной катализ двухстадийного переноса ацильной (R-CO-)-группы, - сначала от субстрата к оксиметильной группе серина, а затем при гидролизе ацилсерина. Третичная структура фермента такова, что три аминокислоты остатка (всего их 245), а именно аспарагиновой кислоты (N 102 в цепи), гистидина (N 57) и серина (N 195), идеально расположены в пространстве для переноса протона:

|
|
|


