 |
3.3.7. Аномальные коэффициенты Бренстеда ()<0 и ()>1
|
|
|
|
3. 3. 7. Аномальные коэффициенты Бренстеда ()< 0 и ()> 1
Кислоты Бренcтеда состоят из протона и его переносчика (сопряженного основания). В переходном состоянии переноса протона протон лежит посредине между старым основанием, отдающим его и новым основанием, которое его забирает. В продукте реакции протон целиком принадлежит новому основанию. Чем более полно в переходном состоянии протон переносится к основанию, т. е. чем ближе переходное состояние к продукту, тем больше влияние структурных изменений (введения заместителей в молекулу кислоты или основания) на константу скорости должно походить на влияние этих же структурных изменений на константу равновесия.
В соответствии с рис. 3. 12, чем ближе величина к единице, тем больше степень переноса протона к основанию, а чем меньше, тем меньше степень образования связи протона в основанием в переходном состоянии. Аналогично высокие и низкие значения связаны соответственно со значительным и незначительным переносом протона от кислоты в переходном состоянии.
Такая точка зрения на смысл коэффициентов и, обоснованная на рис. 3. 12, тем не менее не объясняет экспериментально обнаруженные случаи, когда эти коэффициенты были отрицательны или больше единицы. Например, для нитроалканов =-0, 48:

Для реакции серии 1-арил-2-нитропропанов наблюдалась корреляция скоростей переноса протона к лиатному иону ОН- в водном метаноле с рКа в соответствии с законом Бренстеда, но при этом =1, 68:

Из уравнения (3. 25) следует, что для обратной реакции = -0, 68. Возникают вопросы: как может быть, что степень переноса протона в переходном состоянии больше, чем в продукте, где протон полностью перешел к основанию? Почему формально оказывается, что в обратной реакции принимающий протон атом углерода в переходном состоянии оказывается менее связанным с протоном, чем в анионе, где протон вообще отсутствует? Как связать значения =1, 68 или = -0, 68 с нормальной величиной =0, 5, наблюдавшейся при отщеплении протона от C2H5NO2 под действием различных аминов?
|
|
|
Одно из объяснений необычного поведения 1-арил-2-нитропропанов при депротонировании состоит в утверждении, что в данном случае энергия переходного состояния при изменении Ar изменяется сильнее, чем энергия конечного продукта (аниона). Это значит, что при изменении арильной группы (например, при введении заместителя в бензольное кольцо) парабола АН не просто передвигается вертикально вверх или вниз, но и меняет свою форму, т. е. становится или более, или менее крутой (ср. рис. 3. 11). Реакции нитроалканов уменьшают уверенность в том, что и характеризуют степень переноса протона в переходном состоянии. Однако в большинстве других случаев это предположение справедливо и обычно согласуется в данными о строении переходного состояния, полученными совершенно иными методами. Поэтому уравнение Бренстеда используется очень широко.
3. 3. 7. в. Кривизна графиков Бренстеда
Если ряд кислот (АН) с разными рКа реагирует с одним и тем же основание В, то в пределе коэффициент должен меняться от 0 до 1:
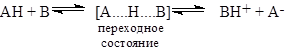
Если кислота АН очень слабая (т. е. ее сопряженное основание А- намного сильнее принимающего протон основания В), то переходное состояние должно достигается только при почти полном переносе протона (1). С другой стороны, когда сопряженное основание кислоты АН значительно слабее В, переходное состояние достигается рано (по координате реакции), и имеет низкую величину (напомним, что =0 может означать переход к лимитирующей стадии диффузии; см. выше). Таким образом, при широком варьировании НА будет меняться и графики Бренстеда не будут линейными.
И действительно, кривизна графиков Бренстеда иногда наблюдалась на практике, но не так часто, как следовало бы ожидать.
|
|
|


