 |
Изомерия органических соединений.
|
|
|
|
Изомеры – вещества, отвечающие одной молекулярной формуле, но имеющие различное химическое строение (структурные изомеры) или различное расположение атомов или групп атомов в пространстве (пространственные или стереоизомеры).
Для биоорганической и биологической химии изомерия является причиной разной биологической активности.
То есть только определенные изомеры проявляют биологическую активность, которая может исчезнуть в процессе изомеризации, что вызывает патологические изменения в организме человека.
Различают структурную и пространственную изомерию органических веществ.
Виды структурной изомерии органических соединений
Структурные изомеры отличаются друг от друга химическим строением и, следовательно, обладают разными химическими свойствами.
Различают виды структурной изомерии:
1. Изомерия углеродного скелета
Формуле С4 Н10 соответствуют:
СН3-СН2-СН2-СН3 н-бутан
СН3-СН(СН3)-СН3 изо-бутан, 2-метилпропан
2. Изомерия положения кратной связи
Формуле С4Н8 соответствуют:
СН2=СН-СН2-СН3 бутен-1
СН3-СН=СН-СН3 бутен-2
4. Изомерия положения функциональной группы
Формуле С3Н7NН2 соответствуют:
СН3-СН2-СН2-NН2 пропанамин-1
СН3-СН-СН3 пропанамин-2
ǀ
NН2
5. Изомерия функциональной принадлежности (межклассовая изомерия)
Формуле С2Н6О соответствуют:
СН3-СН2-ОН этанол
СН3-О-СН3 диметиловый эфир
Стереоизомерия органических соединений
Стереоизомеры различаются пространственным расположением атомов или групп атомов.
Различают виды стереоизомерии:
1. конформационная изомерия
2. энантиомерия
3. σ –диастереомерия
4. π- диастереомерия (геометрическая)
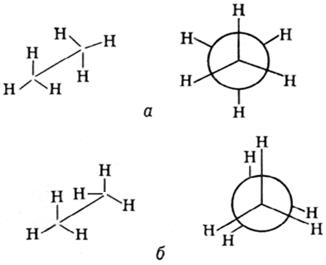
Конформа́ция молекулы (от лат.conformatio — форма, построение, расположение) — пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей. Молекулы, отличающиеся только своими конформациями, называются конформерами, или поворотными изомерами. Существование конформации обусловлено пространственным взаимодействием (например, отталкиванием, притяжением, образованием водородных связей) не связанных между собой заместителей, в т.ч. и атомов водорода. Благодаря данному свойству органические молекулы с большим числом таких связей (например, белки) могут принимать различные конформации. Энергетически конформации различаются незначительно. Конформация с наименьшей энергией является наиболее устойчивой.
|
|
|
Например, на рис. a изображена заторможенная конформация этана, более устойчивая, чем заслоненная конформация, изображенная на рис. б.
Энантиомеры – это изомеры, которые относятся друг к другу как предмет и несовместимое с ним в пространстве зеркальное отражение.
Энантиомерия возможна у любых органических соединений, имеющих центр хиральности (от греч.сhiro – рука). Хиральным центром называют sp3- гибридный атом углерода, соединенный с 4-мя разными заместителями (асимметрический атом углеродаC*).
Хиральные молекулы не могут быть совмещены в пространстве.
Например молекула молочной кислоты (2-гидроксипропановая кислота)
СН3-СН(ОН)-СООН существует в виде двух энантиомеров.
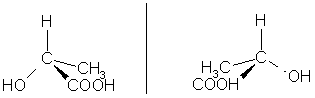
Для изображения энантиомеров на плоскости используют проекционные формулы Фишера.
В зависимости от конфигурации хирального центра различают D- и L- конфигурации (формы). В D-форме функциональная группа(-ОН) хирального центра располагается справа от углеродной цепи; в L-форме –функциональная группа хирального центра (-ОН) располагается слева от углеродной цепи.
СООН СООНǀ ǀ
|
|
|
 |  |

 Н ОН НО Н
Н ОН НО Н
СН3 СН3
D- молочная кислота L- молочная кислота
Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации света. Оптическая активность энантиомеров исследуется с помощью прибора – поляриметра, в котором луч света, пройдя через специальную призму Николя колеблется только в одной плоскости, т,е. становится плоскополяризованным. У энантиомеров угол вращения плоскости поляризации света одинаковый, но направление вращения противоположное. Один энантиомер – левовращающий, знак (-); другой правовращающий, знак (+).Знак вращения плоскости поляризации света не связан с принадлежностью к Д- или L-ряду, он определяется экспериментально. Таким образом, энантиомеры, обладают одинаковыми физическими и химическими свойствами, но являются оптическими антиподами, т.е. имеют противоположную оптическую активность и имеют различную физиологическую активность.
σ-Диастереомерия возникает в молекулах с двумя и более центрами хиральности.
σ-Диастереомеры – оптические изомеры, не являющиеся зеркальным изображением друг друга.Число стереоизомеров в хиральных структурах рассчитывают по формуле Фишера:
Z =2n, где n-число центров хиральности.
Например в молекуле 2,3,4–тригидроксибутаналя СН2(ОН)-СН(ОН)-СН(ОН)-СНО n=2; существует Z = 22 = 4 стереоизомера, т.е. две пары энантиомеров.
D-, L-определяющим является гидроксил при нижнем асимметрическом атоме углерода.
Если заместители в центрах хиральности находятся по одну сторону углеродной цепи, то такой стереоизомер называют эритро-формой, если по разные стороны, то трео-формой.
 СОН СОН СОН СОН
СОН СОН СОН СОН



 Н ОН НО Н НО Н Н О Н
Н ОН НО Н НО Н Н О Н



 Н ОН НО Н Н ОН НО Н
Н ОН НО Н Н ОН НО Н
СН2ОН СН2ОН СН2ОН СН2ОН
Д – эритроза L-эритроза Д-треоза L-треоза


энантиомеры энантиомеры
σ-Диастереомеры не являются зеркальными изображениями друг друга, они имеют разные физические и химические свойства.
π-дастереомеры (цис- и транс-)- это стереоизомеры, отличающиеся друг от друга пространственным расположением одинаковых заместителей относительно плоскости π-связи. Бутендиовая кислота НООС-СН=СН-СООН образует 2 p -диастереомера:
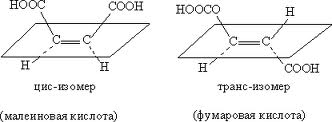
Фумаровая кислота содержится как в растительных, так и животных организмах, где она образуется как промежуточный продукт обмена углеводов в анаэробных условиях.
|
|
|
Малеиновая кислота токсична, в природе не встречается, получается синтетическим путём.
Таким образом,p-диастереомеры отличаются друг от друга по физическим и химическим свойствам, а также по физиологическому действию. Более устойчивыми являются транс-p-диастереомеры.
Контрольные вопросы
1. Изомерия как специфическое явление органической химии. Структурная изомерия, ее виды.
2. Стереохимия как область химии, изучающая пространственное строение органических соединений. Конфигурация и конформация как важнейшие понятия стереохимии.
3. Конформации открытых цепей. Проекционные формулы Ньюмена. Энергетическая характеристика конформационных состояний.
4. Конформация циклических соединений. Аксиальные и экваториальные связи.
5. Энантиомерия. Оптическая активность. Д и L – система стереохимической номенклатуры. Проекционные формулы Фишера. Глицериновый альдегид как конфигурационный стандарт. Рацематы.
6. Диастереомерия. s - Диастереомерия. p - Диастереомерия как стереоизомерия в ряду соединений с двойной связью.
7. Связь пространственного строения органических соединений с их биологической активностью.
Типовые задания
|
|
|


