 |
3.1.1 Классификация электродов
|
|
|
|
3. 1. 1 Классификация электродов
Различают основные типы электродов:
- первого рода, обратимые относительно катиона или относительно аниона;
- второго рода, обратимые относительно и катиона, и аниона;
- окислительно-восстановительные (редокс-электроды);
- ионнообменные (мембранные) электроды.
Электроды первого рода
а) электроды, обратимые относительно катиона.
В этих электродах на границе раздела фаз устанавливается равновесие между молекулярной формой элемента и катионом этого элемента в растворе. Это, например, двухфазные электроды, у которых металл опущен в раствор хорошо растворимой соли этого металла: цинковый 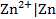 , кадмиевый
, кадмиевый 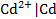 , медный
, медный  , а также трехфазный газовый водородный электрод
, а также трехфазный газовый водородный электрод  .
.
Пример. Рассчитаем электродный потенциал электрода 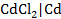 , если моляльность раствора хлорида кадмия равна 0, 1 моль/кг H2O.
, если моляльность раствора хлорида кадмия равна 0, 1 моль/кг H2O.
Решение:
Сначала запишем электродную реакцию:

Число электронов, участвующих в электродной реакции,  .
.
Потенциал такого электрода при T = 298K:
 , (3. 6)
, (3. 6)
Активность металлического кадмия  = 1, активность иона Cd2+ принимаем равной средней ионной активности хлорида кадмия
= 1, активность иона Cd2+ принимаем равной средней ионной активности хлорида кадмия  . Средняя ионная активность электролита равна произведению средней ионной моляльности
. Средняя ионная активность электролита равна произведению средней ионной моляльности 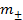 на средний ионный коэффициент активности
на средний ионный коэффициент активности  :
:
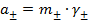 , (3. 7)
, (3. 7)
причемсредняя ионная моляльность:
 , (3. 8)
, (3. 8)
где 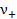 и
и  - количества катионов и анионов, на которые распадается молекула электролита,
- количества катионов и анионов, на которые распадается молекула электролита, 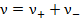 .
.
|
|
|
Средний ионный коэффициент активности  найдем по таблице 72 [2] для заданной моляльности, а стандартный электродный потенциал – по таблице 79 [2].
найдем по таблице 72 [2] для заданной моляльности, а стандартный электродный потенциал – по таблице 79 [2].
В таком случае для  получим:
получим:

Подставим полученное значение в выражение (3. 6):
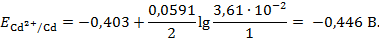
Чем больше активность раствора 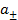 , тем более положителен электродный потенциал.
, тем более положителен электродный потенциал.
б) электроды, обратимые относительно аниона.
В этих электродах на границе раздела фаз устанавливается равновесие между молекулярной формой элемента и анионом этого элемента в растворе.
К таким электродам относятся, например, селеновый  , трехфазные газовые электроды: хлорный
, трехфазные газовые электроды: хлорный  кислородный электрод
кислородный электрод 
Рассмотрим кислородный электрод 
Электродная реакция:
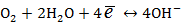 .
.
Выражение для равновесного потенциала этого электрода (Т = 298К):
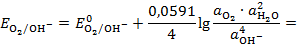

при 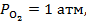
 ;
; 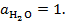
 принимаем равной средней ионной активности в растворе электролита.
принимаем равной средней ионной активности в растворе электролита.
С увеличением активности раствора электролита потенциал таких электродов становится более отрицательным.
Электроды второго рода
Электроды второго рода – это трехфазные электроды, представляющие собой металл, покрытый труднорастворимым соединением этого металла, находящимся в контакте с раствором электролита с анионом, одноименным с анионом труднорастворимого соединения металла (если малорастворимым соединением металла является его оксид, то анионом хорошо растворимого соединения является ион  ).
).
Примерами электродов второго рода являются хлорсеребряный электрод 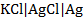 ; каломелевый электрод
; каломелевый электрод  . Такие электроды обратимы относительно и катиона, и аниона.
. Такие электроды обратимы относительно и катиона, и аниона.
Рассмотрим хлорсеребряный электрод.
Электродная реакция:
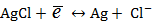 .
.
Потенциал (Т = 298К):


= 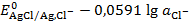 , (3. 10)
, (3. 10)
где  определяется средней ионной активностью КCl a±, KCl.
определяется средней ионной активностью КCl a±, KCl.
Электродную реакцию, протекающую в хлорсеребряном электроде можно записать в две стадии:
|
|
|
Ag –  ↔ Ag+
↔ Ag+
Ag+ +  ↔ AgCl
↔ AgCl
Потенциалопределяющей реакцией является первая стадия. Тогда равновесный потенциал хлорсеребряного электрода можно выразить как потенциал электрода первого рода:

Активность иона Ag+ определяется произведением растворимости труднорастворимой соли LAgCl, т. е.
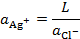
Тогда:

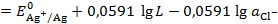
Откуда следует, что
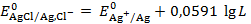
Электроды второго рода, например, хлорсеребряный и каломелевый, применяются в качестве электродов сравнения, т. к. они имеют стабильное, хорошо воспроизводимое значение потенциала.
Пример: Рассчитаем электродный потенциал каломелевого электрода  , если моляльность раствора хлорида калия равна 0, 1 моль/кг H2O.
, если моляльность раствора хлорида калия равна 0, 1 моль/кг H2O.
Решение: Сначала запишем электродную реакцию, протекающую по твердофазному механизму:

Число электронов, участвующих в электродной реакции,  .
.
Потенциал такого электрода при T=298K:
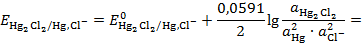
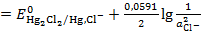 =
= 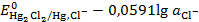 (3. 12)
(3. 12)
Активность иона  равна средней ионной активности хлорида калия:
равна средней ионной активности хлорида калия:

Средний ионный коэффициент активности 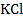 находим по таблице 72 [2] для заданной моляльности:
находим по таблице 72 [2] для заданной моляльности:  = 0, 770.
= 0, 770.
В результате получим:
 В
В
|
|
|


