 |
Окислительно-восстановительные электроды (редокс-электроды)
|
|
|
|
Окислительно-восстановительные электроды (редокс-электроды)
Это электроды состоят из инертного металла, являющегося переносчиком электронов, погруженного в раствор, содержащий как восстановленную, так и окисленную формы вещества, например: 
 .
.
Рассмотрим электрод  .
.
Электродная реакция:
 .
.
Потенциал данного электрода (Т=298К):
 . (3. 13)
. (3. 13)
Потенциал окислительно-восстановительного электрода зависит от соотношения активностей (концентраций) окисленной и восстановленной форм вещества.
3. 1. 2 Классификация гальванических элементов
Гальванические элементы делятся на химические и концентрационные, а также на гальванические элементы с переносом и без переноса ионов через границу раздела жидких фаз.
Концентрационные гальванические элементы
Химическая природа электродов в таких элементах одинакова; ЭДС возникает вследствие различных активностей (концентраций) электродных растворов, например:



причем 


ЭДС таких элементов определяется отношением активностей (концентраций) электродных растворов:
 ,
,
поскольку стандартные потенциалы электродов одинаковы и, следовательно, стандартная ЭДС:

Химические гальванические элементы
ЭДС таких элементов возникает вследствие различной химической природы электродов, например:

ЭДС такого элемента:

зависит от отношения  к
к 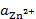 и стандартной ЭДС (при Т = 298К)
и стандартной ЭДС (при Т = 298К)  .
.
Пример: Для гальванического элемента

запишем уравнения реакций, протекающих на электродах при работе (замыкании внешней цепи гальванического элемента), и суммарную химическую реакцию, самопроизвольно протекающую при работе гальванического элемента.
|
|
|
Решение:
Данный гальванический элемент состоит из электрода второго рода (слева) и электрода первого рода, обратимого относительно аниона (справа). Слева всегда записывается электрод с меньшим значением электродного потенциала, на нем всегда идет реакция окисления; справа всегда записывается электрод с большим значением электродного потенциала, на нем всегда идет реакция восстановления. На левом электроде протекает реакция окисления:
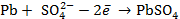 .
.
На правом электроде протекает реакция восстановления:
 .
.
Суммарная реакция, протекающая при работе гальванического элемента, получится путем сложения двух полуреакций окисления и восстановления на электродах:
 .
.
Гальванические элементы с переносом и без переноса ионов через границу раздела жидких фаз
Гальванические элементы делятся на элементы с переносом ионов через границу раздела жидких фаз и элементы без переноса ионов через границу раздела жидких фаз.
Для раздела жидких фаз в гальванических элементах используются пористые мембраны (сепараторы) или электролитические мостики. При использовании мембран на границе раздела жидкость (1)  жидкость (2) возникает диффузионный потенциал из-за разной подвижности ионов. При использовании электролитического мостика с близкой подвижностью ионов диффузионный потенциал значительно меньше.
жидкость (2) возникает диффузионный потенциал из-за разной подвижности ионов. При использовании электролитического мостика с близкой подвижностью ионов диффузионный потенциал значительно меньше.
Все рассмотренные выше гальванические элементы были элементами с переносом ионов через границу раздела жидких фаз.
Гальванические элементы без переноса ионов через границу раздела жидких фаз – это элементы с одним раствором или расплавом электролита или с твердым электролитом. В этих элементах проблемы диффузионного потенциала отсутствуют. Пример гальванического элемента без переноса ионов через границу раздела жидких фаз:
|
|
|
(Pt) H2  HCl
HCl  AgCl
AgCl  Ag
Ag
Данный гальванический элемент состоит из водородного и хлорсеребряного электродов с одной общей жидкой фазой – раствором HCl. Причем ионы 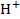 соляной кислоты участвуют в электродной реакции на водородном электроде, а ионы
соляной кислоты участвуют в электродной реакции на водородном электроде, а ионы  - в электродной реакции на хлорсеребряном электроде.
- в электродной реакции на хлорсеребряном электроде.
Гальванические элементы без переноса используются для определения средних ионных коэффициентов активности электролитов, а также в большинстве химических источников тока.
|
|
|


