 |
При патологии распад белков может превалировать над их синтезом, и азота поступает в организм меньше, чем выделяется (отрицательный азотистый баланс).
|
|
|
|
При патологии распад белков может превалировать над их синтезом, и азота поступает в организм меньше, чем выделяется (отрицательный азотистый баланс).
Причинами отрицательного азотистого баланса являются инфекционная лихорадка, обширные травмы, ожоги и воспалительные процессы, злокачественные новообразования, то есть фактически состояния, сопровождаемые ответом острой фазы.
ü В механизме подобных изменений участвуют кахексин, или TNFa, IL-6 и IL-1, вырабатывающиеся клетками иммунной системы. Указанные цитокины тормозят синтез белков, подавляют аппетит и способствуют переходу аминокислот из скелетных мышц в печень и инсулиннезависимые ткани.
ü При этих состояниях альбумин-глобулиновый коэффициент в крови становится меньше нижней границы нормы - 1, 1. В условиях протекания острофазных реакций для сохранения азотистого баланса необходимо усиленное питание и увеличение суточного потребления белков, что, однако, затруднено не только вследствие сниженного аппетита, но из-за угнетения ферментативной и других функций желудочно-кишечного тракта.
К другой группе этиологических факторов отрицательного азотистого баланса относятся эндокринные заболевания (СД, гипертиреоз, гиперкортицизм), стресс, обезвоживание, белковое голодание, лучевая болезнь, гиповитаминозы А, С, В1, В2, В6, РР, дефицит фолиевой кислоты, недостаточность любой из незаменимых аминокислот.
Механизм усиленного распада белков и снижения их синтеза при любых видах стресса и эндокринных патологиях связан с «перераспределением» ам инокислот из мышечных клеток в печеночные клетки, а также с усилением глюконеогенеза, опосредованного повышенной продукцией катаболических гормонов (глюкокортикоидов, катехоламинов, глюкагона и др. ).
|
|
|
Следствием отрицательного азотистого баланса являются дистрофические изменения в органах, похудание, в детском возрасте - задержка роста и умственного развития.
Резюме
Белки являются основой всех жизненных процессов. Нарушение их обмена приводит к тяжелейшим последствиям: органной и тканевой дистрофии, остановке физического и умственного развития, угнетению деятельности иммунной и эндокринной систем, нарушению всех других видов обмена. Патология белкового обмена может возникать на любых этапах.
Причинами недостаточного усвоения белков чаще всего служат заболевания органов желудочно-кишечного тракта. Нарушения синтеза белков возникают при недостатке аминокислот или энергии, расстройствах нейроэндокринной регуляции, мутациях в геноме клетки.
Показателем белкового обмена служит азотистый баланс. В норме сохраняется азотистое равновесие - разница между суточным количеством поступающего с пищей азота и его долей, выделенной за тот же период в составе азотсодержащих компонентов мочи и кала (мочевина, мочевая кислота, аминокислоты, креатинин, соли аммония), практически отсутствует. Для клинической оценки азотистого баланса используется формула М. Денке и Дж. Уилсона (1998): Азотистый баланс (г) = потребление белка (г) / 6, 25 - азот мочевины мочи (г) + 2, 5 г (эквивалент немочевинного азота и потерь азота помимо мочи). При различных отклонениях возможен отрицательный и положительный азотистый баланс.
12. 6. 3. Нарушение обмена аминокислот
Аминокислоты поступают в кровь и ткани из пищеварительного тракта; кроме того, они образуются при деструкции тканевых белков под действием внутриклеточных катепсинов (протеиназ).
Основная часть аминокислот используется в организме в качестве строительных блоков при синтезе белков. Кроме того, аминокислоты используются для синтеза пуриновых и пиримидиновых оснований, гормонов, гема, различных биологически активных пептидов (IL, факторы роста и т. д. ), меланина, глюкозы, жирных кислот и ряда других веществ. Глицин и глутамат играют роль нейромедиаторов ЦНС. Аминокислоты, не использованные для вышеупомянутых целей, подвергаются окислению до CO2 и Н2О с освобождением энергии.
|
|
|
В норме при окислении аминокислот освобождается 10-15% образующейся в организме энергии. Окисление аминокислот усиливается при избыточном поступлении их в организм, голодании, СД, гипертиреозе, снижении синтеза белков и некоторых других состояниях.
Катаболизм большинства аминокислот начинается с отщепления от них аминогруппы, что происходит в 2 типах реакций, происходящих в основном в печени: трансаминирования и дезаминирования.
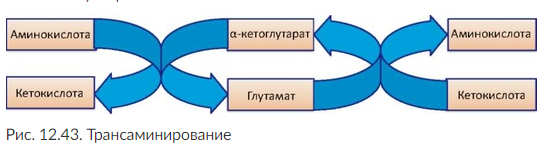
Трансаминирование - обратимый перенос аминогруппы аминокислоты на α -кетокислоту без освобождения аммиака; в результате образуются новая кетокислота и новая аминокислота. Способствует образованию структурно новых заменимых аминокислот.
Процесс трансаминирования легко обратим и катализируется аминотрансферазами, коферментом которых является пиридоксальфосфат - производное витамина В6 (служит переносчиком аминогрупп). Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях выше остальных, - глутамат, аланин, аспартат и соответствующие им кетокислоты - α -кетоглутарат, пируват, оксалацетат.
Основным посредником служит глутаминовая кислота и ее кетоаналог - α -кетоглутарат. Принимая аминогруппу, он превращается в глутамат - донор аминогрупп, способный передавать их любым α -кетокислотам для образования новых аминокислот (рис. 12. 43). Кетокислоты, образующиеся при трансаминировании (например, пировиноградная), также могут использоваться для синтеза глюкозы или окисляться до CO2 и Н2О, подобно глюкозе и жирным кислотам.
Транс-аминирование - начальный этап катаболизма аминокислот, в результате которого аминный азот перераспределяется в тканях организма. Реакции трансаминирования играют роль в превращении аминокислот в кетокислоты или в образовании из кетокислот ряда заменимых аминокислот в том случае, если организм испытывает в них потребность. При трансаминировании общее количество аминокислот в клетке не меняется.
|
|
|
Нарушение процесса трансаминирования в целом организме происходит при гиповитаминозе В6, при недостатке α -кетокислот (голодание, СД). Нарушение трансаминирования в отдельных органах, например в печени, происходит при некрозе клеток, что сопровождается выходом аминотрансфераз в кровь. Такое же явление имеет место при инфаркте миокарда. В поврежденных клетках может быть нарушен синтез белковой части аминотрансфераз.
Дезаминирование - реакция отщепления α -аминогруппы от аминокислоты, в результате чего образуется соответствующая α -кетокислота
(может использоваться в реакциях трансаминирования) и выделяется молекула аммиака. Процесс окислительного дезаминирования снижается в связи с ослаблением трансаминирования, при гипоксии, гиповитаминозах В2, РР, С, белковом голодании.
Нарушение процессов трансаминирования и окислительного дезаминирования аминокислот ограничивает их использование для синтеза глюкозы, жирных кислот, заменимых аминокислот, а также их окисление с освобождением энергии. При этом повышается содержание свободных аминокислот в сыворотке крови и в моче (гипераминоацидемия и гипераминоацидурия), снижается синтез мочевины. Такие нарушения особенно выражены при обширных повреждениях гепатоцитов (вирусные и токсические гепатиты и др. ), так как в этих клетках метаболизм аминокислот происходит наиболее интенсивно.
Наряду с внепочечной гипераминоацидурией, обусловленной усиленным поступлением аминокислот из крови в мочу, существует почечная форма гипераминоацидурии, связанная с нарушением реабсорбции аминокислот в почечных канальцах, при этом содержание аминокислот в сыворотке крови нормальное или даже пониженное (см. главу 20).
Гипераминоацидурия (физиологическая) обнаруживается у детей раннего возраста в связи с функциональной неполноценностью (незрелостью) эпителия почечных канальцев; у беременных женщин повышается экскреция с мочой гистидина и ряда других аминокислот.
|
|
|
Декарбоксилирование - реакция отщепления α -карбоксильной группы от аминокислоты. В тканях идет декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ -оксиглутаминовой кислот, 3, 4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α -аминомалоновой кислоты. В результате образуются CO2 и биогенные амины: гистамин - из гистидина, серотонин - из 5-окситриптофана, тирамин - из тирозина, ГАМК - из глутаминовой кислоты, дофамин (предшественник катехоламинов) - из 3, 4-диоксифенилаланина и др. При декарбоксилировании производных цистеина образуется таурин, используемый в синтезе желчных кислот.
Эти процессы необратимы и катализируются декарбоксилазами, коферментом которых является пиридоксальфосфат (производное витамина В6); при его дефиците образование биогенных аминов снижается. В частности, уменьшается образование ГАМК, которая является основным тормозным нейромедиатором; как следствие, наблюдается развитие судорог. Биогенные амины обладают высокой физиологической активностью. Наряду с ГАМК серотонин и дофамин являются также нейромедиаторами в ЦНС, их повышенное или пониженное содержание в ткани мозга играет роль в патогенезе некоторых форм нейропатологии (депрессии, паркинсонизма, шизофрении). Повышенное образование в организме серотонина (при опухоли, развивающейся из энтерохромафинных клеток кишечника) сопровождается спазмом мускулатуры бронхов и кишечника, диареей, усилением агрегации тромбоцитов; кроме того, серотонин является мощным вазоконстриктором. Хорошо известна роль гистамина в патогенезе боли, развитии воспаления и аллергических реакций.
Устранение избытка биогенных аминов происходит при участии аминооксидаз, которые катализируют превращение их в альдегиды после отщепления аминогруппы в виде NH3. Серотонин превращается в оксииндолилуксусную кислоту, которая выделяется с мочой.
Резюме
Наиболее важными путями внутриклеточного метаболизма аминокислот являются трансаминирование, дезаминирование и декарбоксилирование.
Благодаря первым двум реакциям печень создает оптимальный баланс аминокислот в крови. Эти реакции обратимы и нарушаются при гипоксии, гиповитаминозах В6 и В2, РР, С, белковом голодании, недостатке α -кетокислот (голодание, СД). Обширные повреждения печени и миокарда сопровождаются выходом аминотрансфераз в кровь.
Декарбоксилирование - необратимая реакция, приводящая к образованию CO2 и биогенных аминов. Нарушения ее связаны с дефицитом пиридоксальфосфата (витамина В6) или дефектами ферментов - декарбоксилаз.
|
|
|


