 |
Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
|
|
|
|
Ионный обмен протекает на тех адсорбентах, которые являются полиэлектролитами (ионообменники, иониты, ионообменные смолы).
Ионный обменом называется процесс эквивалентного обмена ионов, находящихся в ионообменнике, на другие ионы того же знака, находящиеся в растворе. Процесс ионного обмена обратим.
Иониты подразделяются на катиониты, аниониты и амфотерные иониты.
Катиониты – вещества, содержащие в своей структуре фиксированные отрицательно заряженные группы (фиксированные ионы), около которых находятся подвижные катионы (противоионы), которые могут обмениваются с катионами, находящимися в растворе (рис. 81).

Рис. 81. Модель матрицы полиэлектролита (катионита) с фиксированными анионами и подвижными противоионами, где – – фиксированные ионы;
 – коионы,
– коионы,  – противоионы
– противоионы
Различают природные катиониты: цеолиты, пермутиты, силикагель, целлюлоза, а также искусственные: высокомолекулярные твердые нерастворимые ионогенные полимеры, содержащие чаще всего сульфогруппы, карбоксильные, фосфиновокислые, мышьяковокислые или селеновокислые группы. Реже применяются синтетические неорганические катиониты, являющиеся чаще всего алюмосиликатами.
По степени ионизации ионогенных групп катиониты делят на сильнокислотные и слабокислотные. Сильнокислотные катиониты способны обменивать свои подвижные катионы на внешние катионы в щелочной, нейтральной и кислой средах. Слабокислотные катиониты обменивают противоионы на другие катионы только в щелочной среде. К сильнокислотным относят катиониты с сильно диссоциированными кислотными группами – сульфокислотными. К слабокислотным относят катиониты, содержащие слабодиссоциированные кислотные группы – фосфорнокислотные, карбоксильные, оксифенильные.
|
|
|
Аниониты – ионообменники, которые содержат в своей структуре положительно заряженные ионогенные группы (фиксированные ионы), около которых находятся подвижные анионы (противоионы), которые могут обмениваться с анионами, находящимися в растворе (рис. 82). Различают природные и синтетические аниониты.

Рис. 82. Модель матрицы полиэлектролита (анионита) с фиксированными катионами и подвижными противоионами, где + – фиксированные ионы;
 – коионы,
– коионы,  – противоионы
– противоионы
Синтетические аниониты содержат в макромолекулах положительно заряженные ионогенные группы. Слабоосновные аниониты имеют в своем составе первичные, вторичные и третичные аминогруппы, сильноосновные аниониты содержат группы четвертичных ониевых солей и оснований (аммониевых, пиридиниевых, сульфониевых, фосфониевых). Сильноосновные аниониты обменивают подвижные анионы в кислой, нейтральной и щелочной средах, слабоосновные – только в кислой среде.
Амфотерные иониты содержат и катионные, и анионные ионогенные группы. Эти иониты могут сорбировать одновременно и катионы и анионы.
Количественной характеристикой ионита является полная обменная емкость (ПОЕ). Определение ПОЕ можно осуществить статическим или динамическим методом, основанном на реакциях, протекающих в системе «ионит – раствор»:
RSO3–H+ + NaOH → RSO3–Na+ + H2O
RNH3+OH– + HCl → RNH3+Cl– + H2O
Емкость определяется числом ионогенных групп в ионите и поэтому теоретически должна быть постоянной величиной. Однако практически она зависит от ряда условий. Различают статическую обменную емкость (СОЕ) и динамическую обменную емкость (ДОЕ). Статическая обменная емкость — полная емкость, характеризующая общее количество ионогенных групп (в миллиэквивалентах), приходящихся на единицу массы воздушно-сухого ионита или нa единицу объема набухшего ионита. Природные иониты имеют небольшую статическую обменную емкость, не превышающую 0,2—0,3 мэкв/г. Для синтетических ионообменных смол она находится в пределах 3—5 мэкв/г, а иногда достигает 10,0 мэкв/г.
|
|
|
Динамическая, или рабочая, обменная емкость относится только к той части ионогеппых групп, которые участвуют в ионном обмене, протекающем в технологических условиях, например, в ионообменной колонке при определенной относительной скорости движения ионита и раствора. Динамическая емкость зависит от скорости движения, размеров колонки и других факторов и всегда меньше статической обменной емкости.
Для определения статической обменной емкости ионитов применяют различные методы. Все эти методы сводятся к насыщению ионита каким-либо ионом, затем вытеснению его другим ионом и анализу первого в растворе. Например, катионит удобно полностью перевести в Н+-форму (противоионами являются ионы водорода), затем промыть его раствором хлорида натрия и полученный кислый раствор оттитровать раствором щелочи. Емкость равна отношению количества перешедшей в раствор кислоты к навеске ионита.
При статическом методе титруют кислоту или щелочь, которые в результате ионообменной адсорбции появляются в растворе.
При динамическом методе ПОЕ определяется с помощью хроматографических колонок. Через колонку, заполненную ионообменной смолой, пропускают раствор электролита и регистрируют зависимость концентрации поглощаемого иона в выходящем растворе (элюате) от объема прошедшего раствора (выходная кривая). ПОЕ рассчитывают по формуле
 , ,
| (337) |
где V общ– суммарный объем раствора, содержащий вытесненную из смолы кислоту; с – концентрация кислоты в этом растворе; m – масса ионообменной смолы в колонке.
Константу равновесия ионного обмена можно определить из данных о равновесном распределении ионов в статических условиях (равновесное состояние при ионном обмене описывается законом действия масс), а также динамическим методом по скорости перемещения зоны вещества по слою смолы (элюентная хроматография).
Для реакции ионного обмена

константа равновесия равна
 , ,
| (338) |
где 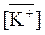 ,
,  – концентрация ионов в ионите;
– концентрация ионов в ионите;  ,
,  – концентрация ионов в растворе.
– концентрация ионов в растворе.
|
|
|
Применяя иониты, можно умягчить воду или опреснять засоленную воду и получать пригодную для фармацевтических целей. Другое применение ионообменной адсорбции в фармации состоит в использовании его для аналитических целей как метода извлечения из смесей того или другого анализируемого компонента.
Примеры решения задач
1. В 60 мл раствора с концентрацией некоторого вещества 0,440 моль/л поместили активированный уголь массой 3 г. Раствор с адсорбентом взбалтывали до установления адсорбционного равновесия, в результате чего концентрация вещества снизилась до 0,350 моль/л. Вычислите величину адсорбции и степень адсорбции.
Решение:
Адсорбция рассчитывается по формуле (325):


По формуле (326) определяем степень адсорбции

2. По приведенным данным для адсорбции димедрола на поверхности угля рассчитайте графически константы уравнения Ленгмюра:
| с, моль/л | 3,00 | 4,26 | 5,42 | 6,84 |
| а, мкмоль/м2 | 0,80 | 0,86 | 0,89 | 0,90 |
Рассчитайте адсорбцию димедрола при концентрации 3,8 моль/л.
Решение:
Для графического определения констант уравнения Ленгмюра используем линейную форму этого уравнения (327):
 .
.
Рассчитаем значения 1/ а и 1/ с:
| 1/ а, м2/мкмоль | 1,25 | 1,163 | 1,12 | 1,11 |
| 1/ с, л/моль | 0,33 | 0,23 | 0,18 | 0,146 |
Строим график в координатах 1/ а – 1/ с (рис. 83).

Рис. 83. Графическое определение констант уравнения Ленгмюра
В том случае, когда точка х = 0 расположена за пределами рисунка, используют второй способ (См. «Вводный блок. Основы математической обработки экспериментальных данных») определения коэффициентов прямой y=ax+b. Вначале выбираем две любые точки, лежащие на прямой (рис. 83) и определяем их координаты:
(·)1(0,15; 1,11); (·)2 (0,30; 1,25).
Затем рассчитываем угловой коэффициент по формуле:

Далее по уравнению рассчитываем значение коэффициента b:
b= y1 – ax1 = 0,11 – 0,93· 0,15 = 0,029.
Получаем, что b = 1/ а ¥ = 0,029 мкмоль/м2, следовательно а ¥ = 34,48 мкмоль/ м2.
Константа адсорбционного равновесия K определяется следующим образом:
 ;
;
 ;
;
 л/моль.
л/моль.
Рассчитаем адсорбцию димедрола при концентрации 3,8 моль/л по уравнению Ленгмюра (327):
|
|
|

3. При изучении адсорбции бензойной кислоты на твердом адсорбенте получены следующие данные:
| с, моль/л | 6,00 | 25,0 | 53,0 | |
| x/m, моль/г | 0,44 | 0,78 | 1,04 | 1,44 |
Рассчитать графически константы уравнения Фрейндлиха. Рассчитать адсорбцию бензойной кислоты при концентрации 0,028 моль/л.
Решение:
Для расчета констант уравнения Фрейндлиха необходимо использовать линейную форму уравнения (332), в координатах lg(х/т) – lg с изотерма имеет вид прямой.
Найдем значения lg c и lg x/m, входящие в линеаризованное уравнение Фрейндлиха.

| lg c | –2,22 | –1,6 | –1,275 | –0,928 |
| lg x/m | –0,356 | –0,11 | 0,017 | 0,158 |
Строим график в координатах lg(х/т) – lg с (рис. 84).

Рис. 84. Графическое определение констант уравнения Фрейндлиха
Так как точка х = 0 расположена за пределами рисунка (84), используем второй способ определения коэффициентов прямой y=ax+b (См. «Вводный блок. Основы математической обработки экспериментальных данных»). Вначале выбираем две любые точки, лежащие на прямой (например, точки 1 и 2) и определяем их координаты:
(·)1 (–2,0; –0,28); (·)2 (–1,0; 0,14).
Затем рассчитываем угловой коэффициент по формуле:


Далее по уравнению рассчитываем значение коэффициента b:
b= y 1 – ax 1 = –0,28 – 0,42 · (–2,0) = 0,56.
Константы уравнения Фрейндлиха равны:
lg K = b= 0,56; K = 100,56= 3,63;
1/ n = а = 0,42.
Рассчитаем адсорбцию бензойной кислоты при концентрации 0,028 моль/л, используя уравнение Фрейндлиха (330):
 .
.
4. Используя уравнение БЭТ, рассчитайте удельную поверхность адсорбента по данным об адсорбции газообразного азота:
| p/ps | 0,1 | 0,2 | 0,3 | 0,4 |
| а ·10–3, м3/кг | 0,71 | 0,81 | 0,93 | 1,09 |
Площадь, занимаемая молекулой азота в плотном монослое, равна 0,08 нм2, плотность азота 1,25 кг/м3.
Решение:
Уравнение изотермы полимолекулярной адсорбции БЭТ в линейной форме имеет вид (333)

Для построения графика определим значения: 
 , кг/моль , кг/моль
| ||||
| p/ps | 0,1 | 0,2 | 0,3 | 0,4 |
Строим график в координатах  – p/ps (рис. 85).
– p/ps (рис. 85).
Используем первый способ (См. «Вводный блок. Основы математической обработки экспериментальных данных») определения коэффициентов прямой y=ax+b. По графику определяем значение коэффициента b, как ординату точки, лежащей на прямой, у которой абсцисса равна 0 (х = 0): b = 5.Выбираем точку на прямой и определяем ее координаты:
(·)1 (0,2; 309).
Затем рассчитываем угловой коэффициент:


Рис. 85. Графическое определение констант уравнения изотермы полимолекулярной адсорбции БЭТ
Константы уравнения изотермы полимолекулярной адсорбции БЭТ равны:
 ;
;  .
.
Решая систему уравнений, получаем а ∞ = 6,6·10–8 м3/кг.
Чтобы вычислить предельное значение адсорбции, отнесем а ∞ к 1 моль:
|
|
|
 .
.
Величину удельной поверхности адсорбента находим по формуле (329):
 .
.
5. Полистирольный сульфокатионит в Н+-форме массой 1 г внесли в раствор KCl с исходной концентрацией с 0= 100 экв/м3 объемом V = 50 мл и смесь выдержали до равновесного состояния. Рассчитайте равновесную концентрацию калия в ионите, если константа ионообменного равновесия  = 2,5, а полная обменная емкость катионита ПОЕ = 5 моль-экв/кг.
= 2,5, а полная обменная емкость катионита ПОЕ = 5 моль-экв/кг.
Решение:
Для определения константы ионного обмена используем уравнение (338). В смоле ионы Н+ обмениваются на эквивалентное количество ионов K +, а суммарное содержание ионов равно ПОЕ. Пусть 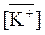 равно х, тогда
равно х, тогда
 = ПОЕ –
= ПОЕ – 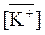 = 5 – х.
= 5 – х.
Равновесная концентрация ионов Н+ в растворе, проявляющихся в результате вытеснения их из ионита, равна

Равновесная концентрация ионов K + в растворе составляет:
 = с 0 –
= с 0 –  = 100 – 20 х
= 100 – 20 х
С учетом полученных выражений для равновесных концентраций ионов уравнение константы ионного обмена можно записать так:
 .
.
После преобразования получаем:
 .
.
Решение квадратного уравнения дает


Значение х 1 намного больше ПОЕ, следовательно, 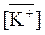 = 3,06 моль-экв/кг.
= 3,06 моль-экв/кг.
6. Рассчитайте количество сульфокатионита в Н+-форме и анионита в ОН–-форме, необходимое для очистки 1000 м3 природной воды, содержащей 0,025 г/л NaCl, 0,04 г/л MgSO4, 0,12 г/л Ca(HCO3)2. ПОЕ катионита 4,2 экв/кг, анионита – 3,5 экв/кг.
Решение:
Определим концентрацию сульфокатионита в Н+-форме солей.






Рассчитаем суммарное количество сульфокатионита в Н+-форме:

Масса сульфокатионита в Н+-форме определяется по формуле (337):


Суммарное количество анионита в ОН–-форме равно:

Масса анионита в ОН–-форме также определяется по формуле (337):

|
|
|


