 |
Задачи для самостоятельного решения.
|
|
|
|
1. Найти степень заполнения поверхности аэросила при адсорбции натриевой соли бензилпенициллина из растворов с концентрацией 0,004; 0,0075; 0,011 М, если адсорбция описывается уравнением Лэнгмюра с константой адсорбционного равновесия равной 790 М–1.
(Ответ: 0,76; 0,86; 0,897)
2. Степень адсорбции пропионовой кислоты из водного раствора углем массой 2 г составила 60%. Определите массу пропионовой кислоты (г) в 1 л водного раствора до адсорбции, если удельная адсорбция равна 2,32·10–3 моль/г.
(Ответ: 0,572 г)
3. В результате изучения сорбции натриевой соли бензилпенициллина из водного раствора на поверхности адсорбента получены следующие данные:
| с ×103, моль/л | 0,25 | 0,5 | ||
| а ×102, моль/г | 1,88 | 2,80 | 4,98 | 6,20 |
Рассчитать константу адсорбционного равновесия и предельную величину адсорбции, если процесс сорбции описывается уравнением Лэнгмюра.
(Ответ K = 1,61 м3/моль; 1/ а ∞ = 15,26 г/моль)
4. Рассчитать адсорбцию уксусной кислоты при концентрации 0,5 кмоль/м3. По опытным данным определить графически константы уравнения Ленгмюра.
| с, моль/л | 0,26 | 0,44 | 0,54 | 0,87 | 1,11 |
| а, мкмоль/м2 | 0,22 | 0,28 | 0,30 | 0,36 | 0,40 |
(Ответ: K = 0,177 л/моль; а ∞ = 5 мкмоль/ м2; а = 0,406 мкмоль/ м2)
5. Постройте кривую адсорбции ацетона на активированном угле при 231°С по следующим данным:
| с ацет, ммоль/л | 2,34 | 14,65 | 88,62 | 177,7 | 268,97 |
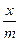 , ммоль/г , ммоль/г
| 0,208 | 0,618 | 1,50 | 2,08 | 2,88 |
Используя уравнение Фрейндлиха, рассчитайте количество ацетона, адсорбированного на 1 г угля при с ацет = 125 ммоль/л.
(Ответ: 1,78 ммоль/г)
6. При 77,5 К на серебряном катализаторе была снята изотерма адсорбции криптона, которая характеризуется следующими данными:
| р, мм рт.ст. | 0,0992 | 0,1800 | 0,3686 | 0,5680 | 0,6843 |
| V газа, адсорбированного 1 кг катализатора, см3/г | 0,0127 | 0,0150 | 0,0176 | 0,0190 | 0,0198 |
Рассчитайте константы в уравнении БЭТ, удельную поверхность катализатора, приняв площадь одной молекулы криптона равной 19,5·10–20 м2, плотность раствора криптона равна 3,739 г/л, давление насыщенного пара криптона 2,57 мм рт.ст.
|
|
|
(Ответ: 68 м2/г; 0,5; 763,05 см2/г)
7. При изучении адсорбции метанола получены данные
| р, кПа | 1,28 | 2,56 | 3,84 | 5,12 | 6,40 |
| а, ммоль/г | 7,5 | 8,0 | 8,3 | 8,6 | 8,8 |
Рассчитайте адсорбцию метанола при давлении 4,05 кПа.
(Ответ: 8,63 ммоль/г)
8. В 150 мл раствора H2SO4 с концентрацией 0,110 моль/л ввели 3 г сильноосновного анионита в ОН–-форме. После установления равновесия ионного обмена отобрали 50 мл раствора, для нейтрализации которого потребовалось 22 мл раствора КОН концентрацией 0,05 моль/л. Рассчитайте ПОЕ анионита.
(Ответ: 9,9 экв/кг).
9. Полная обменная емкость сухого сульфокатионита в Na+-форме равна 4,8 моль/кг. Определите предельно возможное количество (в г) кобальта (II) и бария (II), которое может сорбировать из соответствующих растворов 1 кг исходного ионита.
(Ответ: 141,4 г Со, 329,6 г Ва)
10. Полная обменная емкость анионита в Cl– - форме равна 4,2 моль/кг. Рассчитайте предельно возможное количество (в г) кобальта (II) и золота (III), которое может сорбировать 1 кг исходного ионита из растворов хлороводородной кислоты, если указанные элементы находятся в виде комплексных анионов [CоCl4]2– и [AuCl4]–.
(Ответ: 124 г Со, 827 г Au)
11. Ввели 3 г полистирольного сульфокатионита в Н+-форме, полная обменная емкость которого 5,12 экв/кг, в 0,2 л водного раствора CsCl исходной концентрации 8·10–2 моль/л. Определите равновесные концентрации ионов Н+ и Cs+ в растворе и в ионите, если константа ионообменного равновесия равна 2,7.
(Ответ: 3,25 экв/кг (в ионите); 31,28 экв/м3 (в растворе))
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсолютнаяошибка, 24
Адгезия, 270
Адсорбция, 278
Амфотерные иониты, 304
Аниониты, 303
Бимолекулярные реакции, 219
Внутренняя энергия, 74
|
|
|
Внутренняя энергия одноатомного идеального газа, 73
Время полуреакции, 220
Второе начало термодинамики, 90
Выборка, 12
Генеральная совокупность, 12
Геометрический смысл производной, 65
Гетерогенная система, 117
Гидрофильные поверхности, 273
Гидрофобные поверхности, 273
Гистерезис, 298
Гомогенная система, 117
Графическая интерполяция, 41
Графическая экстраполяция, 40
Графический метод определения порядка, 230
Грубая ошибка, 22
Диаграмма с верхней и нижней температурами взаиморастворения, 131
Диаграмма с верхней критической точкой, 129
Диаграмма с верхней температурой взаиморастворения, 129
Диаграмма с нижней и верхней критической точкой, 131
Диаграмма с нижней критической точкой, 131
Диаграмма с нижней температурой взаиморастворения, 131
Диаграмма состояния воды, 119
Дисперсия, 13
Дисперсия отдельного измерения, 13
Дисперсия среднего значения, 14
Дифильные молекулы, 281
Дифференциальные методы определения порядка, 228
Дифференциальный метод Вант-Гоффа, 232
Доверительная вероятность, 16
Доверительный интервал, 15
Дробная экстракция, 134
Единичное отклонение, 14
Зависимость констант равновесия химической реакции от температуры, 110
Закон Гесса, 81
Закон Дальтона, 107
Закон действующих масс для кинетики, 218
Закон распределения случайных величин Гаусса, 12
Значащие цифры, 27
Изменение теплоемкости в процессе протекания химической реакции, 84
Изменение функции Гельмгольца и Гиббса в химической реакции, 100
Изменение функции Гиббса реакции в стандартных условиях, 105
Изменение энтропии в процессе изменения объема, 92
Изменение энтропии в химической реакции, 92
Изменение энтропии при фазовом переходе, 92
Изотерма поверхностного натяжения, 279
Инвариантная система, 120
Интегральная форма уравнения изобары, 110
Интегральная форма уравнения Клапейрона – Клаузиуса, 120
Интегральные методы определения порядка, 228
Ионный обмен, 302
Истинная теплоемкость, 74
Капиллярная конденсация, 297
Капиллярное давление, 298
Катиониты, 302
Когезия, 269
Компоненты, 118
Константа (концентрационная), 103
Константа Михаэлиса, 256
Константа равновесия, 249
Константа скорости, 218
Константа химического равновесия, выраженная через равновесные парциальные давления, 104
|
|
|
Коэффициент гидрофильности, 274
Коэффициент поверхностного натяжения, 261
Коэффициент распределения, 134
Краевой угол смачивания, 265
Кривая нормального распределения, 13
Кривая охлаждения, 126
Критерий Стьюдента, 18
Критерий Фишера, 15
Критическое значение критерия Фишера, 15
Линия ликвидуса, 129
Линия солидуса, 129
Метод избытка реагента, 232
Метод линеаризации, 59
Метод наименьших квадратов, 47
Метод определения порядка реакции по периоду полупревращения, 231
Метод подстановки (определение порядка), 228
Метод сталагмометра (метод счета капель), 264
Методы измерения поверхностного натяжения, 263
Молекулярность химической реакции, 219
Моновариантная система, 119
Мономолекулярные реакции, 219
Обратимые реакции, 248
Общий порядок реакции, 218
Объем выборки, 13
Однокомпонентные системы, 118
Однократная экстракция, 134
Основной постулат химической кинетики, 218
Относительнаяошибка, 24
Ошибкикосвенных измерений, 25
Ошибки прямыхизмерений, 24
Параллельные реакции, 250
Первое начало термодинамики, 72
Перегонка с водяным паром, 132
Периметр смачивания, 265
Период полупревращения, 221
Площадь, занимаемая одной молекулой, 286
Поверхности раздела фаз, 260
Поверхностная активность, 280
Поверхностная избыточная энергия Гиббса, 261
Поверхностно-активные вещества, 281
Поверхностно-инактивные вещества, 281
Поверхностный слой, 260
Полная обменная емкость, 304
Порядок реакции по данному веществу, 218
Последовательные реакции, 251
Правило Вант-Гоффа, 241
Правило Дюкло-Траубе, 287
Правило Панета – Фаянса – Пескова, 301
Правило фаз Гиббса, 118
Предельная адсорбция, 283
Предэкспоненциальный множитель, 242
Приборные ошибки, 26
Принцип независимости химических реакций, 248
Промахи, 22
Работа адгезии, 270
Работа когезии, 270
Работа расширения газа, 72
Работа, совершаемая в результате протекания химической реакции, 72
РаспределениеСтьюдента, 15
Расходный коэффициент пара, 133
Расчет константы химического равновесия при стандартных условиях и температуре, 105
Расчет равновесного выхода продуктов реакции, 111
|
|
|
Расчет энтропии при нагревании, 91
Реакция второго порядка, 222
Реакция нулевого порядка, 220
Реакция первого порядка, 221
Систематическая ошибка, 22
Скорость реакции, 238
Скорость реакции по продукту, 212
Скорость реакции по реагенту, 212
Скорость средняя, 212
Следствия из закона Гесса, 81
Случайная ошибка, 22
Среднее арифметическоезначение, 13
Среднее квадратичное отклонение отдельного измерения, 14
Среднее квадратичное отклонение среднего, 14
Средняя мольная теплоемкость, 74
Стандартная энтальпия (теплота) образования вещества, 82
Стандартная энтальпия (теплота) сгорания вещества, 83
Стандартная энтропия, 91
Стандартное состояние, 82
Степень адсорбции, 293
Степень заполнения поверхности адсорбатом, 286
Степень извлечения при однократной экстракции, 135
Таблицы Excel, 48
Температура эвтектики, 129
Температурный коэффициент поверхностного натяжения, 272
Температурный коэффициент скорости реакции, 241
Теория вероятностей, 12
Теория полимолекулярной адсорбции, 295
Термодинамическая система, 117
Толщина адсорбционного слоя, 286
Тримолекулярные стадии, 219
Тройная точка, 120
Удельная поверхностная избыточная энергия Гиббса, 272
Удельная поверхностная избыточная энтальпия, 272
Удельная свободная поверхностная энергия, 261
Уравнение Аррениуса, 241
Уравнение Гиббса – Гельмгольца, 272
Уравнение Дюпре, 271
Уравнение изобары Вант-Гоффа (дифференциальная форма), 110
Уравнение изотермы адсорбции теории БЭТ, 296
Уравнение изохоры Вант-Гоффа (дифференциальная форма), 110
Уравнение Кирхгофа, 84
Уравнение Клапейрона – Клаузиуса (дифференциальная форма), 120
Уравнение Клапейрона (дифференциальная форма), 120
Уравнение Лапласа для капиллярного давления, 298
Уравнение Ленгмюра для границы твердая фаза – газ или твердая фаза – жидкость, 293
Уравнение Менделеева – Клапейрона, 71
Уравнение Михаэлиса – Ментен:, 255
Уравнение мономолекулярной адсорбции Ленгмюра для границы газ – жидкость, 283
Уравнение Томсона – Кельвина, 299
Уравнение Фрейндлиха, 293
Уравнение Шишковского, 286
Уравнение Юнга для краевого угла смачивания, 265
Уровень значимости, 16
Ускоренное определение срока годности лекарственного препарата, 243
Фаза, 117
Фазовое равновесие, 118
Фазовые диаграммы, 124
Ферменты, 254
Число степеней свободы, 14, 118
Экстракция, 134
Элементарная реакция (стадия), 218
Энергия активации, 242
Энергия Гельмгольца, 96
Энергия Гиббса, 96
Энергия связи, 83
Энтальпия, 74
Энтальпия (стандартная) химической реакции – расчет по стандартным энтальпиям образования, 81
Энтальпия (стандартная) химической реакции – расчет по стандартным энтальпиям сгорания, 83
|
|
|
Энтальпия смачивания, 273
Энтальпия химической реакции – расчет по энергиям связей, 83
ПРИЛОЖЕНИЕ
|
|
|


