 |
Кислая среда. Щелочная среда. Нейтральная среда. Расчёт Э. Д. С. Тема 11. Гальванические элементы (Г. Э. ). Химические источники тока (Х. И. Т. )
|
|
|
|
Кислая среда
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
K++MnO4‾ +2Na++SO32-+2H++SO42-→ Mn2++SO42-+2Na++SO42-+2K++SO42-+H2O
MnO4‾ +SO32-+2H+→ Mn2++SO42-+H2O
н. о. к.

 MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O х 2 (в-ие)
MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O х 2 (в-ие)
 | 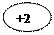 |
ок-ль 10
 SO32- + H2O - 2 ē → SO42- + 2 H+ х 5 (ок-ие)
SO32- + H2O - 2 ē → SO42- + 2 H+ х 5 (ок-ие)

 в-ль
в-ль
6 3
2 MnO4‾ + 5 SO32- + 16 H+ + 5 H2O → 2 Mn2+ +5 SO42-+ 8 H2O + 10 H+
2 KMnO4 + 5 Na2SO3 + 3 H2SO4 → 2 MnSO4 + 5 Na2SO4 + K2SO4 + 3 H2O
Щелочная среда
KMnO4 + Na2SO3 + КОН → К2MnO4 + Na2SO4 + H2O
K+ + MnO4‾ + 2 Na+ + SO32- + К+ + ОН‾ → 2 К+ + MnO42- + 2 Na+ + SO42- + H2O
MnO4‾ + SO32- + 2 H+ → Mn2+ + SO42- + H2O
н. о. к.


 MnO4‾ + 1 ē → MnO42- х 2 (в-ие)
MnO4‾ + 1 ē → MnO42- х 2 (в-ие)
ок-ль 2
 SO32- + 2 OН‾ - 2 ē → SO42- + 2 H2О х 1 (ок-ие)
SO32- + 2 OН‾ - 2 ē → SO42- + 2 H2О х 1 (ок-ие)

 в-ль
в-ль
 |
2 MnO4‾ + SO32- + 2 ОН‾ → 2 MnO42- + SO42-+ H2O
13 = 13
2 KMnO4 + Na2SO3 + 2 KOH → 2 K2MnO4 + Na2SO4 + H2O
Нейтральная среда
KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOН
K+ + MnO4‾ + 2 Na+ + SO32- + H2O → MnO2 + 2 Na+ + SO42- + K++ OН‾
MnO4‾ + SO32- → MnO2 + SO42-
н. о. к.

 MnO4‾ + 2 H2O + 3 ē → MnO2 + 4 OH‾ х 2 (в-ие)
MnO4‾ + 2 H2O + 3 ē → MnO2 + 4 OH‾ х 2 (в-ие)
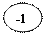
 ок-ль 6
ок-ль 6
 SO32- + H2O - 2 ē → SO42- + 2 H+ х 3 (ок-ие)
SO32- + H2O - 2 ē → SO42- + 2 H+ х 3 (ок-ие)

 в-ль
в-ль
 |
1 2 ОН
 2 MnO4‾ +
2 MnO4‾ + 4 H2O + 3 SO32- + 3 H2O → 2 MnO2 + 3 SO42- + 6 H + + 8 OH‾
|
|
|
18 = 18 6 HOH
2 KMnO4 + 3 Na2SO3 + H2O → 2 MnO2 + 3 Na2SO4 + 2 KOH
Расчёт Э. Д. С.
Количественной характеристикой окислительно-восстановительной способности является окислительно-восстановительный потенциал или стандартный электродный потенциал (φ ˚ или Е˚ В).
Чем больше значение φ ˚, тем сильнее выражены окислительные свойства.
Чем меньше значение φ ˚, тем сильнее выражены восстановительные свойства.
|
1. О. В. Р. возможна, если Э. Д. С. > 0.
2. Если Э. Д. С. < 0, то прямая реакция невозможна.
3. Если Э. Д. С. = 0, то в системе – химическое равновесие.
Возможна ли реакция: Mg + ZnSO4 → Zn + MgSO4?
0 +2 0 +2
Mg + ZnSO4 → Zn + MgSO4
в-ль ок-ль
φ ˚ Zn+2/Zn0 = - 0, 76 В
φ ˚ Mg+2/Mg0 = - 2, 37 В
Э. Д. С. = - 0, 76 – (- 2, 37) = 1, 6 В.
Т. к. Э. Д. С. > 0, то реакция возможна.
ТЕМА 11. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ (Г. Э. )
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА (Х. И. Т. )
Г. Э. – устройство, состоящее из двух полуэлементов, в котором химическая энергия превращается в электрическую.
Полуэлемент – система, состоящая из металлической пластинки, опущенной в раствор собственной соли.
Цинковый и медный полуэлементы
До замыкания цепи













|
 Zn
Zn 









|
 Cu
Cu
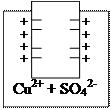 |
Zn/ZnSO4 Cu/CuSO4
Zn0 - 2ē ↔ Zn2+ (1) Cu0 - 2ē ↔ Cu2+ (2)
В обоих полуэлементах образуются электродные потенциалы, однако на цинке будет больший избыток электронов, т. к. он более активный металл, поэтому равновесие (1) в большей степени смещено вправо, чем равновесие (2).
|
|
|
Для замыкания цепи необходимы:
Проводник первого рода – металлическая проволока (для движения электронов по внешней цепи)
Проводник второго рода – стеклянная трубка, заполненная агар-агаром и KCl (электролитический мостик, по которому движутся анионы).
 После замыкания цепи
После замыкания цепи
ē




|








|
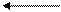 | ||||||
 |
| |||||
SO42-
 | |||||||
 |  | ||||||
 | |||||||
ē


 _
_
(А) Zn / ZnSO4 // CuSO4 / Cu (K)
Равновесие (1) и (2) нарушаются:
 |  |
(1) (А) Zn0 - 2ē → Zn2+ (K) Cu2+ + 2ē → Cu0
Выводы:
 Анод – электрод, на котором Катод – электрод, на котором
Анод – электрод, на котором Катод – электрод, на котором
происходит процесс окисления; происходит процесс восстановления;
• активный металл (φ < ); • неактивный металл (φ > );


 • заряд , т. к. ионы Ме+n из метал – • заряд, т. к. ионы Меn+ переходят из
• заряд , т. к. ионы Ме+n из метал – • заряд, т. к. ионы Меn+ переходят из
лической кристаллической решётки раствора на электрод;
переходят в раствор;
• процесс Ме0 – nē → Men+ - • процесс Меn+ + nē → Ме0 - за счёт (ē ),
избыток (ē ) на (А). которые перешли с анода.
 | |||||||||
 |  |  |  | ||||||










 ●
● 

 ● ●
● ●


 ●
● 

 |  | ||||
 | |||||
 Расчёт ЭДС (Г. Э. )
Расчёт ЭДС (Г. Э. )
ЭДС (электродвижущая сила) – разность потенциалов.
ЭДС = φ (К) – φ (А)
Стандартные условия: ЭДС = φ 0Сu2+/Cu0 – φ 0Zn2+/Zn0 = 0, 34 – (- 0, 76) = 1, 1 В.
|
|
|
Для произвольных условий - по уравнению Нернста:
ЭДС = (φ 0Сu2+/Cu0 + 2, 31·R·Tlg[Cu2+]) – (φ 0Zn2+/Zn0 + 2, 31·R·Tlg[Zn2+])
n·F n·F
ЭДС = (φ 0Сu2+/Cu0 + 0, 059/2·lg[Cu2+]) – (φ 0Zn2+/Zn0 + 0, 059/2·lg[Zn2+])
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ»
Задача
Рассмотрите работу гальванического элемента: Cu/CuCl2//CdCl2/Cd.
[Cu2+] = 0, 1 M; [Cd2+] = 0, 001 M
1. φ рСu2+/Cu0 = φ 0Сu2+/Cu0 + 0, 059/2·lg[Cu2+] = 0, 34 + 0, 059/2·lg10-1 = 0, 3103 В
φ рСd2+/Cd0 = φ 0Сd2+/Cd0 + 0, 059/2·lg[Cd2+] = - 0, 4 + 0, 059/2·lg10-3 = - 0, 4885 B
2. φ рСu2+/Cu0 > φ рСd2+/Cd0 => Cd – (A), Cu – (K).
ē

 3.
3. 
 _
_
(A) Cd/ CdCl2// CuCl2/ Cu (K)
4. ē
|




|







 5. (A) Cd Cu (K)
5. (A) Cd Cu (K)
 | ||||||
 | | |||||
Cl-
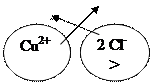 | |||||
 |  | ||||
6. 

(А) Cd0 - 2ē → Cd2+
 |
(K) Cu2+ + 2ē → Cu0
7. ЭДС = φ (К) – φ (А) = 0, 3103 – (-0, 4885) = 0, 7988 В
ТЕМА 12. ЭЛЕКТРОЛИЗ
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах, опущенных в раствор или расплав электролита и подключённых к внешнему источнику постоянного электрического тока.


 ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ
 нерастворимый
нерастворимый

 расплавов растворов
расплавов растворов
растворимый
|
|
|


