 |
4. Перевод одного способа выражения концентрации
|
|
|
|
4. Перевод одного способа выражения концентрации
раствора в другой
Нужно помнить, что масса растворённого вещества – неизменная и общая для формул любого способа выражения концентрации величина, следовательно, при помощи её и производят перевод.
а) перевод массовой доли растворённого вещества в молярную концентрацию.
|
б) перевод массовой доли растворённого вещества в молярную концентрацию эквивалента.
|
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ: «СПОСОБЫ ВЫРАЖЕНИЙ
КОНЦЕНТРАЦИЙ РАСТВОРОВ»
Задача № 1
К 120 мл. раствора с массовой долей NaCl 16 % и плотностью 1, 16 г/см3 прилили воду объёмом 80 мл. Рассчитайте ω %, См, Сн полученного раствора.
 Дано: Решение:
Дано: Решение:
Vр-ра = 120 мл 1. Находим массу 16 % раствора, зная, что
 ρ 1(р-ра) = 1, 16 г/см3 ρ = m , m = ρ *V,
ρ 1(р-ра) = 1, 16 г/см3 ρ = m , m = ρ *V,
ω 1 %(NaCl) = 16 % V
V(H2O) = 80 мл m (р-ра) = 120 *1, 16 = 139, 2 г
ρ 2 = 1, 071 г/см3 2. Из формулы: ω % (р. в. ) = m (р. в. ) *100 % ,
М(NaCl) = 58, 5 г/моль m(р – ра)
определяем m (р. в. ) в 16 % растворе: 
ω 2 %=? m (р. в. ) = ω *m (р-ра),
Сн =?
См =? m (р. в. ) = 0, 16 *139, 2 = 22, 27 г
3. После прибавления воды масса раствора изменилась, т. к. ρ (Н2О) = 1 г/см3, то m (р-ра) = 139, 2 + 80 = 219, 2 г.
|
|
|
4. Находим массовую долю растворённого вещества в новом растворе:
ω 2% = 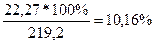
5. Определяем См, зная формулу перерасчета:
См = 
См = 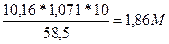
6. Определяем Сн, но т. к. f(NaCl) = 1 и Э = М (NaCl), то
Сн = См = 1, 86 н
Ответ: ω 2% = 10, 16%, См = 1, 86 М, Сн = 1, 86 н
Задача №2
На нейтрализацию 20 мл 0, 2 н раствора соляной кислоты израсходовано 15 мл гидроксида калия. Рассчитайте Сн (КОН).
 Дано: Решение:
Дано: Решение:
V(HCl) = 20 мл 1. Зная закон эквивалентов,
C(HCl) = 0, 2 н Сн (к-ты) *V(к-ты) = Сн (щ) *V(щ),
 V(KOH) = 15 мл находим С(КОН)
V(KOH) = 15 мл находим С(КОН)
Сн (КОН) = 
Ответ: Сн (КОН) = 0, 26 н
ТЕМА 7. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
НЕЭЛЕКТРОЛИТОВ
Неэлектролиты – вещества, которые в водных растворах дробятся до молекул – электронейтральных частиц, поэтому не проводят электрический ток
 Осмос I Закон Рауля
Осмос I Закон Рауля


 Осмос – односторонняя диффузия р0
Осмос – односторонняя диффузия р0
 молекул низкомолекулярного ве- Жидкость ↔ Пар + Δ Н
молекул низкомолекулярного ве- Жидкость ↔ Пар + Δ Н
щества (растворителя) через полу- Н2О t˚ ↑


 проницаемую мембрану. (Ле Шателье)
проницаемую мембрану. (Ле Шателье)
Осмотическое давление – давле – Насыщенный пар – пар,
ние, которое необходимо приложить находящийся в равновесии
к раствору II, чтобы привести его в с жидкостью при данной
равновесие с раствором I. температуре, а его давление –
давление насыщенного пара.
Закон Вант-Гоффа
р1 – давление насыщенного
|
Р0 – давление насыщенного пара
над водой
|
|
|


р1


 n – число моль растворённого вещест- раствор ва (р. в. ) сахара
n – число моль растворённого вещест- раствор ва (р. в. ) сахара
V – объём раствора (л или м3);
R – универсальная газовая р1< р0, т. к. :
(8, 31 Дж/моль·К) • испарение с меньшей поверхности;
T – температура (К) • часть молекул воды связана в
гидратные оболочки с молекулами р. в.
Pосм. –осмотическое давление (Па)
|
над раствором неэлектролита
 |
Соотношения:
 R = 8, 31 Дж/моль·К р – Па
R = 8, 31 Дж/моль·К р – Па
V – 1 м3 – 1·10-3 л
| ||||
| ||||

 R = 0, 081 л·атм/ моль·К р – атм.
R = 0, 081 л·атм/ моль·К р – атм.
V = 1 л
- Закон Рауля n = m/ M
II Закон Рауля
 Повышение температуры кипения Понижение температуры
Повышение температуры кипения Понижение температуры
замерзания
|
| ||||
Е–эбулиоскопическая постоянная К–криоскопическая постоянная
растворителя (в справочнике) растворителя (в справочнике)
|
содержащихся в 1000 г растворителя
|
Δ t˚ кип = t˚ кип. р-ра - t˚ кип. р-ля Δ t˚ зам = t˚ зам. р-ля - t˚ зам. р-ра
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «НЕЭЛЕКТРОЛИТЫ»
|
|
|
Задача № 1
Чему равно при температуре 7, 5º С осмотическое давление раствора, в 1, 5 л корого содержится 276 г глицерина (С3Н8О3).
Росм. = nRT; подставляем данные в формулу.
V
М(С3Н8О3) = 92 г/моль
Росм. = nRT = 276·8, 31·280, 5 = 465 360 Па
V 92·1, 5·10-3
|
|
|


