 |
36. Диссоциация Электролиты. 37. Среда раствора рН. Электролиты Число ионов
|
|
|
|
36. Диссоциация Электролиты

 1. ступенчато ( ) а) FeOHCl2
1. ступенчато ( ) а) FeOHCl2
 2. в одну ступень ( ) б) Fe(OH)3
2. в одну ступень ( ) б) Fe(OH)3
 3. ступенчато (первичная ) в) KHCO3
3. ступенчато (первичная ) в) KHCO3

 (вторичная ) г) ZnCl2
(вторичная ) г) ZnCl2
д) Na[Al(OH)4]
37. Среда раствора рН
1) нейтральная а) рН = 4
2) кислая б) рН = 7
3) щелочная в) рН = 9
г) рН = 11
38. При диссоциации электролитов образуется число ионов
Электролиты Число ионов
1)KAl(SO4)2 а) 3 иона
2)Fe2(SO4)3 б) 2 иона
3)CrBr3 в) 4 иона
4)AlCl3 г) 5 ионов
д) 6 ионов
Установите правильную последовательность действий:
39. При составлении ионных уравнений реакций необходимо:
1) записать схему реакции
2) определить силу электролита
3) расписать сильные электролиты на ионы
4) уравнять атомы
5) сократить одинаковые ионы
 6) записать кратное ионное уравнение
6) записать кратное ионное уравнение
7) в виде молекул записать ( (осадки); (газы); слаб. эл-ты)
Укажите номер правильного ответа:
 40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
40. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
 1) (NH4)2CO3 + HBr
1) (NH4)2CO3 + HBr
 2) Li2CO3 + H2SiO3
2) Li2CO3 + H2SiO3
 3) CaCO3 + H2SO4
3) CaCO3 + H2SO4
 4) BaCO3 + HCl
4) BaCO3 + HCl
 41. Уравнению реакции Cu(OH)2 + H2SO4 CuSO4 + 2H2O соответствует сокращенное ионное уравнение:
41. Уравнению реакции Cu(OH)2 + H2SO4 CuSO4 + 2H2O соответствует сокращенное ионное уравнение:
 1) 2H+ + 2OH- 2H2O
1) 2H+ + 2OH- 2H2O
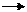 2) Cu(OH)2 + 2H+ Cu2+ + 2H2O
2) Cu(OH)2 + 2H+ Cu2+ + 2H2O
 3) Cu2+ + SO42- CuSO4
3) Cu2+ + SO42- CuSO4
 4) Cu2+ + H2SO4 CuSO4 + 2H+
4) Cu2+ + H2SO4 CuSO4 + 2H+
42. С уменьшением концентрации соли степень диссоциации
|
|
|
1) возрастает 2) уменьшается 3) не изменится
Дополните:
43. В результате гидролиза соли образуется электролит _______
44. Гидролиз соли протекает по катиону, если соль образована основанием________, кислотой _________ и рН = _______
45. Гидролизу не подвергаются соли, образованные __________
Укажите номер правильного ответа:
46. Полному гидролизу подвергается:
1) AlCl3 3)KCl
2) ZnCl2 4) Al2S3
47. Гидролизу не подвергается:
1) Na2CO3 3) Na3PO4
2) NaBr 4) Na2SiO3
Дополните:
48. Степень окисления – это ______________
49. Окисление – процесс _____________
50. Если алгебраическая величина (С. О. ) уменьшается, то протекает процесс___
51. Восстановитель в ходе окислительно-восстановительной реакции _________
52. Сложное вещество, содержащее элемент в высшей степени окисления играет роль _______________
53. Ме – простые вещества являются ______________
54. Чем меньше величина  о, тем сильнее выражены свойства __________
о, тем сильнее выражены свойства __________
55. ЭДС рассчитывают по формуле __________; ЭДС > 0, то ____________
Установите соответствие:
56. Окислительно-восстановительная реакция Тип
 1) 2KNO3 2KNO2 + O2 a) сопропорционирования
1) 2KNO3 2KNO2 + O2 a) сопропорционирования
 2) 2NO2 + H2O HNO3 + HNO2 б) внутримолекулярная
2) 2NO2 + H2O HNO3 + HNO2 б) внутримолекулярная
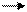 3) 4NH3 + 5O2 4NO + 6H2O в) диспропорционирования
3) 4NH3 + 5O2 4NO + 6H2O в) диспропорционирования
 4) 2Na2S+Na2SO3+3H2SO4 3S+3Na2SO4+3H2O г) межмолекулярная
4) 2Na2S+Na2SO3+3H2SO4 3S+3Na2SO4+3H2O г) межмолекулярная
Укажите номер правильного ответа:
57. В кислой среде (С. О. ) марганца в KMnO4 изменяется до:
1) Mn0 2) Mn+2 3) Mn+4 4) Mn+6
58. Вещество проявляет только окислительные свойства:
1) Сr2(SO4)3 2) Сr0 3) СrSO4 4) K2Сr2O7
59. Окислительно-восстановительную двойственность проявляет:
1) H2SO4 2) Na2SO3 3) Na2SO4 4) H2S
Дополните:
60. Анод – электрод, на котором протекает процесс__________
61. На границе Металл – раствор возникает ______ прилегающий слой жидкости заряжается __________
|
|
|
62. Полуэлементом называют __________
63. Стандартный (нормальный) электродный потенциал металла – это _______
64. В цинковом полуэлементе, условно-графическая схема которого ______, процесс возникновения электродного потенциала отражает xим. уравнение ___
65. Если возрастает концентрация ионов металла в растворе, то электродный потенциал __________
66. Уравнение Нернста при Т = 298 К имеет вид ________
67. j катода ___ j анода.
Установите соответствие:
68. В Г. Э.: Sn | SnSO4 | | NiSO4 | Ni
| Электроды 1) Катод 2) Анод | Металлы и заряды а) Sn б) Ni в) – г) + д) 0 |
Укажите номер правильного ответа:
69. В Г. Э.: Сu | CuCl2 | | ZnCl2| Zn
ЭДС (н. у. ) равно:
1) 0, 42 В 2) 1, 1 В 3) –1, 1 В 4) –0, 42 В
70. Если в гальваническом элементе анод – железный электрод, тогда катод:
1) Zn 2) Mg 3) Sn 4)Cr
Дополните:
71. Электрохимическая коррозия – процесс _____________
72. На анодных участках протекает процесс, называемый _______, а с электронной точки зрения – это ____________
73. Деполяризаторы – вещества, которые ______ к ним относятся: 1)_______
2) _______
74. В кислой среде на катоде протекают два процесса – химизм: 1) _________
2) _________
75. Электрохимическая коррозия возможна, если электродный потенциал анодного процесса ___________
Установите соответствие:
76. Виды коррозии: Примеры:
| 1) по природе окружающей среды: 2) по механизму процесса; 3) по характеру разрушения металла | а) физическая; б) атмосферная; в) химическая; г) местная; д) равномерная; е) электрохимическая; ж) межкристаллитная; з) почвенная; и) биологическая; к) жидкостная |
77. Для защиты металла от коррозии применяют
способы: Примеры:
| 1) химические; 2) физические; 3) электрохимические. | а) эмалирование; б) сульфатирование; в) гальванопокрытие; г) фосфотирование; д) смазка маслами; е) оксидирование; ж) покрытие лаками; з) ингибирование; и) легирование; к) покрытие полимерами; л) пассивирование; м) установление протекторов; н) катодная защита. |
|
|
|
78. Вид коррозионных процессов: При контакте фаз:
| 1) химический 2) электрохимический | а) железо – разбавленная серная кислота; б) железо – концентрированная серная кислота; в) золото – пары йода; г) золото – влажный воздух |
79. Алюминий склёпан медью
| Электроды: 1) анод 2) катод | Металлы и заряды: а) Al б) Cu в) – г) + |
Укажите номер правильного ответа:
80. Покрытие анодное:
1) цинк – медью
2) медь – алюминием
3) медь – золотом
4) алюминий – серебром
При нарушении покрытия во влажном воздухе химизм процесса на электродах_______
Дополните:
81. Устройство для электролиза называется _____, в нем энергия_____, превращается в энергию _______
82. Анод – электрод, на котором идет процесс ____, имеет заряд _____, подходят частицы _____.
83. На катоде в первую очередь разряжаются частицы, j р которых _____.
84. Сила тока (Ja), необходимая для электролиза вычисляется по формуле _____
85. На аноде разряжается кислотный остаток _______.
86. Электрод – «окислитель» это _______.
87. Электролиз с растворимым анодом используется: 1) __________
2) __________
Установите соответствие:
| 88. В состав соли входит металл: 1) малоактивный 2) средней активности 3) активный | На катоде выделяются: а) водород из воды б) металл в) металл и водород из воды |
89. При электролизе раствора соли
| На аноде разряжается: 1) кислотный остаток 2) кислород из воды | Кислотный остаток- анион: а) карбонат б) хлорид в)нитрат г)сульфат д) бромид е) иодид |
Укажите номер правильного ответа:
90. Из смеси катионов: Ag+, Cu2+, Fe2+, Zn2+ в первую очередь восстановятся катионы:
| 1) меди 2) железа | 3) цинка 4) серебра |
91. Для покрытия металла никелем электролиз ведут, используя:
| 1) К - никелевый 2) А - никелевый | 3) К - угольный 4) А - угольный |
92. При электролизе раствора хлорида натрия среда раствора у катода:
|
|
|
1) кислая 2) нейтральная 3) щелочная
93. Кальций можно получить из хлорида кальция путем:
1) электролиза раствора
2) электролиза расплава
3) восстановлением водорода
4) термического разложения
94. При электролизе раствора хлорида меди (анод медный) на аноде окислится:
1) хлор 2) кислород 3) водород 4) медь
95. При электролизе раствора карбоната натрия с графитовыми электродами на аноде происходит:
1) выделение СО2
2) выделение кислорода
3) выделение водорода
4) осаждение натрия
|
|
|


