 |
Список рекомендуемой литературы
|
|
|
|
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Глинка, Н. Л. Общая химия: учебник для бакалавров / Н. Л. Глинка; под ред.: В. А. Попкова, А. В. Бабкова. - 19-е изд., перераб. и доп. - Москва: Юрайт, 2014. - 900 с.
2. Глинка, Н. Л. Задачи и упражнения по общей химии: учеб. пособие / Н. Л. Глинка. - Изд. стер. - М.: КноРус, 2012. - 240 с.
3. Князев, Д. А. Неорганическая химия: учебник для бакалавров / Д. А. Князев, С. Н. Смарыгин. - 4-е изд. - Москв: Юрайт, 2012. - 587 с.
4. Пресс, И. А. Основы общей химии для самостоятельного изучения: учебное пособие / И. А. Пресс. - Изд. 2-е, перераб. - Санкт-Петербург; Москва; Краснодар: Лань, 2012. - 492 с.
5. Глинка, Н. Л. Общая химия: [учеб. пособие] / Н. Л. Глинка. - М.: КноРус, 2011. - 746 с.
6. Павлов, Н. Н. Общая и неорганическая химия: учебник / Н. Н. Павлов. - Изд. 3-е, испр. и доп. - Санкт-Петербург; Москва; Краснодар: Лань, 2011. - 493 с.
7. Кодолов, В. И. Основы общей химии / В. И. Кодолов. - Ижевск: ИжГТУ, 2010. - 396 с.
8. Хомченко, Г. П. Неорганическая химия: учебник / Г. П. Хомченко, И. К. Цитович. - Изд. 2-е, перераб. и доп., репр. - СПб.: Квадро, 2009. - 460 с.
9. Коровин, Н. В. Общая химия: учебник / Н. В. Коровин. - Изд. 10-е, доп. - М.: Высш. шк., 2008. - 557 с.
10. Задачи и упражнения по общей химии: учеб. пособие для вузов / [Адамсон Б. И. и др. ]; под ред. Н. В. Коровина. - Изд. 2-е, испр. - М.: Высш. шк., 2004. - 255 с.
ПРИЛОЖЕНИЕ А
Таблица А. 1 - Стандартные электродные потенциалы металлов
| Металл | Электродный процесс | φ 0298, В |
| Li | Li ↔ Li+ + ē | -3, 045 |
| Rb | Rb ↔ Rb + + ē | -2, 925 |
| К | K ↔ K + + ē | -2, 924 |
| Cs | Cs ↔ Cs + + ē | -2, 923 |
| Ra | Ra ↔ Ra2++2 ē | -2, 92 |
| Ва | Ba ↔ Ba2+ + 2 ē | -2, 905 |
| Sr | Sr ↔ Sr2+ + 2 ē | -2, 888 |
| Са | Ca ↔ Ca2++2 ē | -2, 886 |
| Na | Na ↔ Na + + ē | -2, 714 |
| La | La ↔ La3++3 ē | -2, 522 |
| Се | Се ↔ Се3+ + З ē | -2, 48 |
| Mg | Mg ↔ Mg2+ + 2 ē | -2, 363 |
| Sc | Sс ↔ Sc3+ + 3 ē | -2, 077 |
| Ru | Ru ↔ Ru3++3 ē | -2, 031 |
| Th | Th ↔ Th4+ + 4 ē | -1, 899 |
| Be | Be ↔ Be2+ + 2 ē | -1, 850 |
| Hf | Hf ↔ Hf4+ + 4 ē | -1, 700 |
| Al | Al ↔ Al3+ + 3 ē | -1, 66 |
| Ti | Ti ↔ Ti2+ + 2 ē | -1, 63 |
| Zr | Zr ↔ Zr2+ + 4 ē | -1, 539 |
| Mn | Mn ↔ Mn2++2 ē | -1, 179 |
| V | V ↔ V2++2 ē | -1, 175 |
| Nb | Nb ↔ Nb3++3 ē | -1, 1 |
| Cr | Cr ↔ Cr2++2 ē | -0, 913 |
| Zn | Zn ↔ Zn2+ + 2 ē | -0, 763 |
| Cr | Cr ↔ Cr3++3 ē | -0, 744 |
| Ga | Ga ↔ Ga3+ + 3 ē | -0, 53 |
| Fe | Fe ↔ Fe2++2 ē | -0, 44 |
| Cd | Cd ↔ Cd2++2 ē | -0, 40 |
| Tl | Т1↔ Тl+ + ē | -0, 336 |
| Co | Co ↔ Co2+ + 2 ē | -0, 277 |
| Ni | Ni ↔ Ni2++2 ē | -0, 250 |
| Mo | Mo ↔ Mo3++3 ē | -0, 200 |
| Sn | Sn ↔ Sn2+ + 2 ē | -0, 136 |
| Pb | Pb ↔ Pb2+ + 2 ē | -0, 126 |
| Fe | Fe ↔ Fe3++3 ē | -0, 037 |
| H2 | H2 ↔ 2H + +2 ē | 0, 00 |
| W | W ↔ W3++3 ē | +0, 11 |
| Sb | Sb ↔ Sb2++2 ē | +0, 15 |
| Bi | Bi ↔ Bi3++3 ē | +0, 215 |
| Cu | Cu ↔ Cu2+ + 2 ē | +0, 34 |
| Re | Re ↔ Re3++3 ē | +0, 3 |
Окончание таблицы А. 1
|
|
|
| Металл | Электродный процесс | φ 0298, В |
| Tc | Tc ↔ Tc2+ + 2 ē | +0, 4 |
| Ru | Ru ↔ Ru2++2 ē | +0, 45 |
| Cu | Cu ↔ Cu + + ē | +0, 520 |
| Hg | 2Hg ↔ Hg2++2 ē | +0, 789 |
| Ag | Ag ↔ Ag++ ē | +0, 799 |
| Os | Os ↔ 0s2+ + 2 ē | +0, 85 |
| Hg | Hg ↔ Hg2+ + 2 ē | +0, 852 |
| Pd | Pd ↔ Pd2+ + 2 ē | +0, 987 |
| Jr | Jr ↔ Jr3++3 ē | +1, 15 |
| Pt | Pt ↔ Pt2++2 ē | +1, 188 |
| Au | Au ↔ Au3++3 ē | +1, 50 |
| Au | Au ↔ Au + + ē | +1, 69 |
|
|
|
ПРИЛОЖЕНИЕ Б
Таблица Б. 1 - Стандартные электродные потенциалы некоторых окислительно-восстановительных систем
|
Окисленная форма | Восстановленная форма | Электродная реакция | φ 0298, В | |||
| SO42-
| S | SO32-+4e+ 3H2O = S + 6OH¯ | -0, 90 | |||
| SO42-
| SO32- | SO42- +2ē +H2O=SO32- +2OH¯ | -0, 90 | |||
| NO3¯
| NO2 | NO3¯ + ē +H2O=NO2 + 2OH¯ | -0, 85 | |||
| H2O
| H2 | 2H2O+2ē =H2+2OH¯ | -0, 83 | |||
| AsO43-
| AsO2¯ | AsO43-+2ē +2H2O=AsO2¯ +4OH¯ | -0, 71 | |||
| SO32-
| S2O82- | 2 SO32-+4ē +3H2O=S2O82-+6OH¯ | -0, 58 | |||
| S
| S2- | S+2ē =S2- | -0, 48 | |||
| Cr3+
| Cr2+ | Cr3++ē =Cr2+ | -0, 41 | |||
| H3PO4
| P | H3PO4+5ē +5H+=P+4H2O | -0, 30 | |||
| V3+
| V2+ | V3+ +ē = V2+ | -0, 26 | |||
| NO2¯
| NH3 | NO2¯ +6ē +6H2O=NH4OH+7OH¯ | -0, 16 | |||
| NO3¯
| NO | NO3¯ +3ē +2H2O=NO+4OH¯ | -0, 14 | |||
| NO3¯
| NH4OH | NO3¯ +8ē +7H2O=NH4OH+9OH¯ | -0, 12 | |||
| CrO42 -
| Cr(OH)3 | CrO42- + 2ē +4H2O=Cr(OH3)+5OH¯ | -0, 12 | |||
| NO3¯
| NO2¯ | NO3¯ +2ē +H2O=NO2¯ +2OH¯ | +0, 01 | |||
| S
| H2S | S+2ē +2H+=H2S | +0, 14 | |||
| Sn4+
| Sn2+ | Sn4++2ē =Sn2+ | +0, 15 | |||
| Cu2+
| Cu+ | Cu2++ē =Cu+ | +0, 153 | |||
| [Co(NH3)6]3+
| [Co(NH3)6]2+ | [Co(NH3)6]3++ē =[Co(NH3)6]2+ | +0, 16 | |||
| SO42-
| SO32- | SO42-+2ē +2H+=SO32-+H2O | +0, 20 | |||
| IO3¯
| I2 | IO3¯ +10ē +6H2O=I2+12OH¯ | +0, 21 | |||
| IO3¯
| I¯ | IO3¯ +6ē +3H2O=I2+6OH¯ | +0, 25 | |||
| SO42-
| H2S | SO42-+8ē +10H+=H2S+4H2O | +0, 303 | |||
| Ag20
| Ag | Ag2O+2ē +H2O=2Ag+2OH¯ | +0, 344 | |||
| CIO4¯
| CIO3¯ | CIO4¯ +2ē +H2O=ClO3¯ +2OH¯ | +0, 36 | |||
| [Fe(CN)6]3-
| [Fe(CN)6]4- | [Fe(CN)6]3-+ē =[Fe(CN)6]4- | +0, 36 | |||
| О2
| ОH¯ | O2+2ē +2H2O=4OH¯ | +0, 401 | |||
| H2SO3
| S | H2SO3+4ē +4H+=S+3H2O | +0, 45 | |||
| Ni(OH)3
| Ni(OH)2 | Ni(OH)3+ē =Ni(OH)2+OH¯ | +0, 49 | |||
| Br O3¯
| Br2 | 2 BrO3¯ +10ē +6H2O=Br2+12OH¯ | +0, 50 | |||
| I2
| I¯ | I2+2ē =2I¯ | +0, 536 | |||
| Br O3¯ | BrO¯ | 2ВrO3¯ +4ē +2Н2О= 2 ВrO¯ +40Н¯ | +0, 54 | |||
| MnO4¯
| MnO42- | MnO4¯ +ē =MnO42- | +0, 56 | |||
| ClO4¯
| Cl¯ | С1О4¯ +8ē +4Н2О=Сl¯ +8ОН¯ | +0, 56 | |||
| MnO4¯
| Mn02 | MnO4¯ +3ē +2H2O=MnO2+4OH¯ | +0, 57 | |||
| MnO42-
| MnO2 | MnO42-+2ē +2H2O=MnO2+4OH¯ | +0, 58 | |||
| BrO3¯
| Вr¯ | BrO3¯ +6ē +3H2O=Br¯ +6OH¯ | +0, 61 | |||
| СlO3¯ | Cl¯
| ClO3¯ +6ē +3H2O=Cl¯ +6OH¯ | +0, 63 | |||
Окончание таблицы Б. 1
| Окисленная форма | Восстановленная форма | Электродная реакция | φ 0298, В |
| 02 | H2O2 | O2+2ē +2H+= H2O2 | +0, 68 |
| Fe3+ | Fe2+ | Fe3++ē =Fe2+ | +0, 77 |
| NO3¯ BrO3¯ +6ē +3H2O=Br¯ +6OH¯ BrO3¯ +6ē +3H2O=Br¯ +6OH¯ | NO2 | NO3¯ +ē +2H+=NO2+H2O | +0, 78 |
| NO3¯ | NH4+ | NO3¯ +8ē +l0H+=NH4++3H2O | +0, 87 |
| NO3¯ | NO2¯ | NO3¯ +2ē +2H+= NO2¯ +H2O | +0, 94 |
| ClO¯ | Cl¯ | ClO¯ +2ē +H2O=Cl¯ +2OH¯ | +0, 94 |
| CrO42- | CrO2¯ | CrO42-+3ē +4H+=CrO2¯ +2H2O | +0, 95 |
| N03¯ | NO | NO3¯ +3ē +4H+=NO+2H2O | +0, 96 |
| РЬ304 | PbO | Pb304+2ē +2H+=3PbO+H20 | +0, 97 |
| NO2¯ | NO | NO2¯ +ē +2H+=NO+H2O | +0, 99 |
| Br2 | Вr¯ | Вг2+2ē =2Вrˉ | +1, 07 |
| IO3¯ | I¯ | IO3¯ +6ē +6H+=I¯ +6H2O | +1, 09 |
| IO3¯ | I2 | 2IO3¯ +10ē +12H+=I2+6H2O | +1, 19 |
| 02 | H2O | 02+4ē +4H+=2H2O | +1, 23 |
| NO3¯ | N2 | 2NO3¯ +10ē +l2H+=N2+6H2O | +1, 24 |
| MnO2 | Mn2+ | MnO2+2ē +4H+=Mn2++2H2O | +1, 28 |
| Cl2 | Cl¯ | CI2+2ē =2Cl¯ | +1, 358 |
| NO2 | N2 | 2NO2+8ē +8H+=N2+4H2O | +1, 36 |
| Cr2072- | Cr3+ | Cr2072-+6ē +14H+=2Cr3++7H2O | +1, 36 |
| ClO4¯ | Cl¯ | CIO4¯ +8ē +8H+=Cl¯ +4H2O | +1, 38 |
| ClO4¯ | Cl2 | 2CIO4¯ +14ē +16H+=CI2+8H2O | +1, 39 |
| BrO3¯ | Вr¯ | BrO3¯ +6ē +6Н+=Вr¯ +ЗН2О | +1, 44 |
| ClO3¯ | Cl¯ | ClO3¯ +6ē +6Н+=Cl¯ +ЗН2О 6Н+=Сlˉ +ЗН2О | +1, 45 |
| Pb02 | Pb2+ | PbO2+2ē +4H+=Pb2++2H2O | +1, 45 |
| ClO3¯ | Cl2 | 2ClO3¯ +10ē +12Н+=Cl2+6Н2О | +1, 47 |
| CrO42- | Cr3+ | СrO42=+3ē +8H+=Cr3++4H2O | +1, 48 |
| HClO | Cl¯ | НСlO+2ē +H+=Cl¯ +H2O | +1, 50 |
| MnO4¯ | Mn2+ | MnO4¯ +5ē +8H+=Mn2++4H2O | +1, 50 |
| BrO3¯ | Br2 | 2ВrO3¯ +10ē +12Н+=Br2+6H2O | +1, 52 |
| HClO | CI2 | 2HCIO+2ē +2H+=CI2+2H2O | +1, 63 |
| РЬ02 | PbSO4 | PbO2+2ē +SO42-=PbSO4+2H2O | +1, 68 |
| МпО4¯ | MnO2 | MnO4¯ +3ē +4H+=Mn02+2H2O | +1, 69 |
| H2O2 | H2O | Н2O2+2ē +2Н+=2Н2О | +1, 77 |
| O2 | H202 | O2+2ē +2H+= H2O2 | +1, 77 |
| Со3+ | Co2+ | Со3++ē =Со2+ | +1, 80 |
| S2O82- | SO42- | S2O82-+2ē =2SO42- | +2, 05 |
| МпO42- | MnO2 | МпО42-+2е-+4Н+=МпО2+2Н2О | +2, 26 |
| F2 | F¯ | F2+2ē =2F¯ | +2, 85 |
ПРИЛОЖЕНИЕ В
|
|
|
Таблица В. 1 - Электродные потенциалы металлов в различных средах
| Электрод | pH=7 | pH< 7 | pH> 7 |
| Mg/Mg2+ | -1, 40 | -1, 57 | -1, 14 |
| Al/Аl3+ | -0, 57 | -0, 50 | -1, 38 |
| Mn/Mn2+ | -1, 0 | -0, 88 | -0, 72 |
| Та/Та2+ | -0, 01 | +0, 39 | -0, 30 |
| Zn/Zn2+ | -0, 78 | -0, 84 | -1, 13 |
| Cr/Cr3+ | -0, 08 | +0, 05 | -0, 20 |
| W/W3+ | -0, 02 | +0, 23 | -0, 33 |
| Fe/Fe2+ | -0, 40 | -0, 32 | -0, 10 |
| Cd/Cd2+ | -0, 53 | -0, 51 | -0, 50 |
| Co/Co2+ | -0, 14 | -0, 16 | -0, 09 |
| Mo/Mo2+ | -0, 10 | +0, 35 | -0, 28 |
| Ni/Ni2+ | -0, 01 | -0, 03 | -0, 04 |
| Sn/Sn2+ | -0, 20 | -0, 25 | -0, 84 |
| Pb/Pb2+ | -0, 29 | -0, 23 | -0, 51 |
| Sb/Sb3+ | -0, 06 | +0, 19 | -0, 46 |
| Bi/Bi3+ | -0, 02 | +0, 17 | -0, 24 |
| Cu/Cu2+ | -0, 06 | +0, 15 | +0, 03 |
| Ag/Ag+ | +0, 30 | +0, 33 | +0, 16 |
| Hg/Hg2+ | +0, 23 | +0, 28 | +0, 25 |
| Au/Au3+ | +0, 25 | +0, 35 | +0, 21 |
ПРИЛОЖЕНИЕ Г
Таблица Г. 1 - Перенапряжение выделения водорода и ионизации кислорода на
разных электродах
|
|
|
|
Материал электрода |
Перенапряжение водорода |
Перенапряжение кислорода | ||
| pH< 7 | pH = 7 | рН> 7 | ||
| Ag | 0, 63 | 0, 50 | 0, 36 | 0, 97 |
| А1 | 0, 68 | 0, 46 | 0, 24 | |
| Au | 0, 04 | 0, 03 | 0, 85 | |
| Be | 0, 72 | 0, 59 | 0, 46 | |
| Bi | 0, 48 | 0, 38 | 0, 28 | |
| Cd | 1, 04 | 0, 83 | 0, 61 | 1, 38 |
| Co | 0, 22 | 0, 21 | 0, 20 | 1, 25 |
| Cu | 0, 51 | 0, 56 | 0, 60 | 1, 05 |
| Fe | 0, 34 | 0, 38 | 0, 42 | 1, 07 |
| Ge | 0, 61 | 0, 66 | 0, 61 | |
| С графит | 1, 17 | |||
| Hg | 1, 05 | 1, 12 | 1, 19 | 1, 62 |
| Mn | 0, 48 | 0, 51 | 0, 54 | |
| Mo | 0, 38 | 0, 33 | 0, 28 | |
| Nb | 0, 48 | |||
| Ni | 0, 28 | 0, 31 | 0, 33 | 1, 09 |
| Pb | 1, 22 | 0, 98 | 0, 74 | 1, 44 |
| Pd | 0, 06 | 0, 11 | 0, 15 | |
| Pt | 0, 04 | 0, 07 | 0, 11 | 0, 70 |
| Sb | 0, 66 | 0, 64 | 0, 24 | |
| Sn | 0, 82 | 0, 76 | 0, 70 | 1, 21 |
| Ti | 0, 42 | 0, 42 | 0, 43 | |
| Та | 1, 50 | |||
| Tl | 1, 15 | 0, 88 | 0, 68 | |
| W | 0, 11 | 0, 06 | 0, 01 | |
| Zn | 0, 88 | 0, 86 | 0, 84 | 1, 75 |
| Mg | 1, 22 | 0, 88 | 0, 74 | 2, 55 |
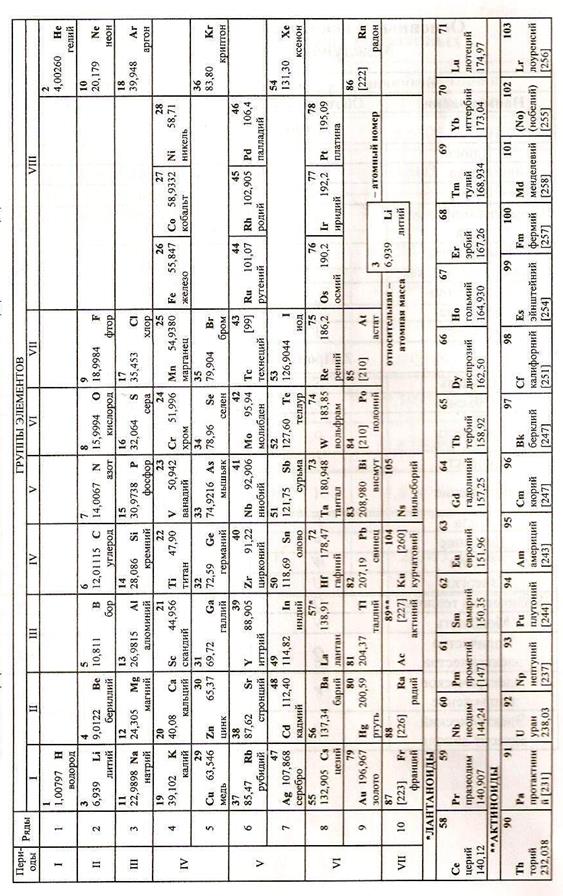
| Таблица Д. 1 – Периодическая система элементов Д. И. Менделеева ПРИЛОЖЕНИЕ Д |
| ПРИЛОЖЕНИЕ Е Таблица Е. 1- Растворимость солей в воде
|
Катион | Pb2+ | М | М | Н | Р | Р | Н | Н | Р | Н | Н | Н | Н | Н | (Р – растворимое вещество, М – малорастворимое, Н- труднорастворимое; черта означает, что вещество не существует или разлагается водой |
| Sn2+ | Р | Р | Р | - | - | Н | - | Р | - | - | - | Н | Н | |||
| AI3+ | Р | Р | Р | Р | Р | - | - | Р | - | Н | - | Н | Н | |||
| Hg2+ | Р | М | Н | Р | Р | Н | Н | - | - | - | Н | Н | - | |||
| Zn2+ | Р | Р | Р | Р | Р | Н | М | Р | Н | Н | Н | Н | Н | |||
| Ba2+ | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Р | |||
| Sr2+ | Р | Р | Р | Р | Р | Р | Р | Н | Н | Н | М | Н | М | |||
| Ca2+ | Р | Р | Р | Р | Р | Р | Н | М | Н | Н | М | Н | М | |||
| Mg2+ | Р | Р | Р | Р | Р | - | Н | Р | Н | Н | Р | Н | Н | |||
| Ag+ | Н | Н | Н | Р | Р | Н | Н | М | Н | - | Н | Н | - | |||
| Cu2+ | Р | Р | - | Р | Р | Н | Н | Р | - | - | Н | Н | Н | |||
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | |||
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |||
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | |||
| Li+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | |||
|
Анион | CI− | Br− | J− | NO3− | CH3COO− | S2− | SO32 | SO42- | CO32- | SiO32- | Cr042- | PO43- | OH− | |||
Учебное издание
|
|
|


