 |
Часть В. Дайте полное решение заданий
|
|
|
|
1. Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
2. Установите правильную последовательность действий при определении типа гибридизации Ц. А. в частице:
1. Определите тип гибридизации;
2. Вычислите ст. ок., Ц. А. и число неспаренных (  );
);
3. Найдите Ц. А. в частице;
4. Укажите К. Ч. (Ц. А. ) и число  связей;
связей;
5. Графически изобразите валентные (  ) Ц. А. в соответствующей степени окисления.
) Ц. А. в соответствующей степени окисления.
6. Определите валентные электроны, участвующие в образовании связей в периферийных атомах и покажите их перекрывание с ГАО Ц. А.
7. Изобразите структурную формулу, указывающую геометрию частицы.
Установите соответствие:
3. Тип гибридизации Ц. А. Частица
1) sp2 a) Н2О
2) sp3 б) ВН3
3) sp3d в) SCl6
4) sp3d2 г) CO
5) sp д) PCl5
Рассмотрите по алгоритму те частицы, в которых Ц. А. в sp3 и sp3d гибридизации.
Укажите номер правильного ответа:
4. Если в момент химического равновесия 2NO + O2  2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
5) 12 моль/л и 8 моль/л
6) 14 моль/л и 8 моль/л
7) 16 моль/л и 12 моль/л
8) 32 моль/л и 24 моль/л
|
|
|
5. Окисление аммиака протекает по уравнению:
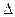 Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O
Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O 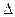 Н x. p. = -1528 кДж
Н x. p. = -1528 кДж
кДж/моль г г г ж (-285, 84)
теплота образования аммиака ( 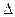 Н0 обр. (NH3)) равна:
Н0 обр. (NH3)) равна:
1) -92, 15 кДж/моль
2) 92, 15 кДж/моль
3) 46, 76 кДж/моль
4) -46, 76 кДж/моль
6. Реакция восстановления оксида меди (II) алюминием возможна
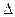 G0 обр. 3CuO + 2Al = Al2O3 + 3Cu
G0 обр. 3CuO + 2Al = Al2O3 + 3Cu
кДж/моль -129, 8 -1582
свободная энергия Гиббса ( 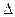 G х. р. ) равна:
G х. р. ) равна:
1) -1192 кДж
2) -3576 кДж
3) +1192 кДж
4) +3576 кДж
7. Массовая доля уксусной кислоты в растворе, полученном при смешивании 300 г 20%-ного раствора, равна_____________г
| 1) 16, 7 | 2) 8, 45 | 3) 33, 4 | 4) 20, 5 |
8. Объём 0, 1 н раствора NaOH необходимый для нейтрализации 20 мл 0, 15 н раствора уксусной кислоты, равен ______г
| 1) 30 | 2) 25 | 3) 50 | 4) 40 |
9. При температуре 200С давление насыщенного пара бензола равно 100 кПа. Давление насыщенного пара над раствором бензола (М = 78 г/моль), в 83 г которого содержится 12, 8 г нафталина (М = 128 г/моль) составляет ___г
| 1) 100 | 2) 99 | 3) 90 | 4) 80 |
10. Осмотическое давление раствора, содержащего 0, 2 г растворённого вещества в 300 мл раствора при 270С равно 27, 7 кПа. Молярная масса растворённого вещества равна _____г
| 1) 60 | 2) 30 | 3) 90 | 4) 66 |
11. Для того, чтобы повысилась температура кипения воды на 1, 040С, необходимо в 500 г растворить _________________ граммов глюкозы (М = 180 г/моль). Е (Н2О) = 0, 52 (град·кг)/моль.
| 1) 180 | 2) 362 | 3) 90 | 4) 250 |
12. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксида натрия образуется:
1) ортофосфат натрия 3) дигидроортофосфат натрия
2) гидроортофосфат натрия 4) фосфат натрия
Составьте молекулярно-ионные уравнения реакций. Сумма всех коэффициентов в кратком ионном уравнении равна________
13. Метилоранж становится желтым при растворении в воде каждой из двух солей:
1) K2S и K3PO4 3) LiCl и FeSO4
|
|
|
2) KNO3 и K3PO4 4) CH3COOK и K2SO4
Составьте молекулярно-ионные уравнения реакций гидролиза.
14. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
1) 10 2) 12 3) 13 4) 9
15. Кислая среда образуется при растворении в воде каждой из двух солей:
1) BaCl2 и AlCl3 3) CuCl2 и LiCl
2) K2S и K3PO4 4) NH4NO3 и Zn(NO3)2
Составьте молекулярно-ионные уравнения гидролиза, выведите константу гидролиза по первой ступени.
16. В уравнении реакции, схема которой
 FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O,
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O,
сумма коэффициентов перед формулами исходных веществ равна:
1) 20 2) 18 3) 25 4) 22
Используйте ионно-электронный метод.
17. В Г. Э. Ag | AgNO3 | | Fe(NO3)2 | Fe укажите процессы на электродах:
1) Fe0 – 2e ® Fe2+
2) Fe2+ + 2e ® Fe0
3) Ag0 – 1e ® Ag+
4) Ag+ + 1e ® Ag0
Рассчитайте ЭДС при н. у.
18. При электролизе раствора сульфата цинка с графитовым анодом и катодом на катоде выделится:
| 1) цинк 2) водород | 3) кислород 4) цинк и водород |
19. Рассмотрите электролиз раствора нитрата серебра, если:
а) графитовые электроды
б) серебряный анод
20. Протектором для железа может быть:
1) хром 2) олово 3) серебро 4) золото
Условно - графическая схема Г. Э. ______ в кислой среде, химизм процессов на электродах ___________
21. В системе при рН < 7, если корродирует железо:
 1) Fe – A 3) Pb – A
1) Fe – A 3) Pb – A
2) Cr – K 4) Pb – K Cr Fe Pb
Г. Э. имеет условно-графическую схему ______
Химизм процессов на электродах____________
|
|
|


