 |
2.2.5 Определение относительного уровня экспрессии генов
|
|
|
|
2. 2. 5 Определение относительного уровня экспрессии генов
Относительный уровень экспрессии генов определяли методом количественной ПЦР в реальном времени (Real-Time PCR) на 3-й, 6-й и 9-й месяц эксперимента в образцах РНК, выделенных из венозной крови из хвостовой вены.
Принципиальной особенностью полимеразной цепной реакции в реальном времени является возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации. Так как кинетика накопления ампликонов напрямую зависит от числа копий исследуемой матрицы, это позволяет проводить количественные измерения кДНК.
Для выявления продуктов амплификации в режиме реального времени использовали интеркалирующий агент SYBR Green. Этот способ детекции основан на том факте, что флуоресценция данного вещества значительно возрастает при внедрении в двухцепочечные молекулы ДНК. Таким образом, можно наблюдать за накоплением продуктов амплификации.
Высушенные осадки РНК растворяли в обработанной диэтилпирокарбонатомдеионизированной воде. Концентрацию РНК измеряли с помощью спектрофотометра Nano Drop 2000 (Thermo Fisher Scientific, Inc., США) по оптической плотности на длине волны 260 нм. Для проведения обратной транскрипции брали 1 мкгРНК каждого образца и помещали в термостат на час при 37-38°С.
Для проведения ПЦР по технологии TaqMan (Applied Biosystems, США) к 2 мкл кДНК образцов добавляли реакционную смесь, содержащую МастерМикс и праймеры, приведённые в таблице 4.
Таблица 4- Состав реакционной смеси на 1 реакцию, для проведения ПЦР по технологии TaqMan
| Вода | 5, 5 мкл |
| МастерМикс | 2, 0 мкл |
| Праймеры | 0, 5 мкл |
| Объем кДНК | 2 мкл |
Амплификацию проводили в термоциклере Real-time CFX96 Touch (Bio-Rad Laboratories, США) по следующей программе: “горячий старт” – +95°С, 5 мин; денатурация – +95°С, 15 сек, отжиг праймеров и элонгация с регистрацией флуоресценции – +56°С, 30 сек (40 циклов) (таблица 5).
|
|
|
Таблица 5- Условия термоциклирования
| 95 °С | 5 минут |
| 95 °С | 15 секунд |
| 56 °С | 30 секунд* |
| 40 циклов |
*детекция по каналу SYBR
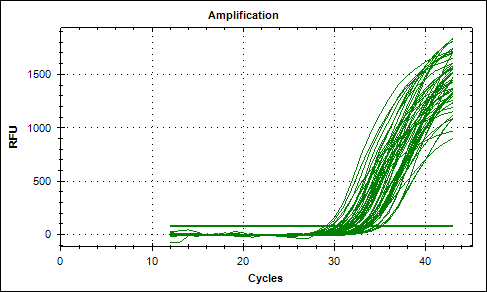
Рисунок 15– Кривые накопления Сt количественной ПЦР на ген Htr4. По оси ординат RFU – сигнал флюоресценции, по оси функции – количество циклов. Используемый фюоресцентный краситель Sybr.
Каталожные номера всех продуктов, используемых в данной дипломной работе приведены в таблице 6.
Таблица 6- каталожные номера продуктов
| Продукт | Каталожный номер |
| МастерМикс | |
| Gapdh | |
| Htr4 | |
| Slc6a4 |
2. 2. 6 Оценка относительного уровня экспрессии генов
Относительный уровень экспрессии генов оценивали методом 2-Δ Δ Ct (Livak, Schmittgen, 2001) на основании результатов, полученных в ходе ПЦР в реальном времени с использованием TaqMan зондов (Applied Biosystems, США).
Метод 2-Δ Δ Ct показывает во сколько раз изменяется экспрессия гена в исследуемой группе по сравнению с таковыми в контрольной группе. Δ Δ Ct рассчитывали как Δ Δ Ct = Δ Ct (исследуемая группа) — Δ Ct (контрольная группа), и каждое значение Δ Ct = Δ Ct (исследуемый ген) — Δ Ct(Gapdh), согласно (Livak, Schmittgen, 2001).
Эксперименты проводили в 3-кратном повторении для каждого образца. Достоверность различий определялась с использованием непараметрического статистического критерия t-тeст, различия считались достоверными при р< 0. 05.
2. 2. 7 Определение уровня гормона кортизола в крови.
Уровень кортизола в плазме определяли с помощью набора реактивов «Кортизол-ИФА-БЕСТ» для иммуноферментного определения концентрации данного гормона в сыворотке крови фирмы «ВЕКТОР-БЕСТ». Метод определения основан на иммуноферментном анализе
|
|
|
Единицы измерения – нмоль/л
2. 2. 8 Статистический анализ
Все статистические анализы проводились с помощью программного обеспечения Excel. Все данные представлены в виде средних значений ± cтандартная ошибка среднего. Графики были сгенерированы с помощью программного обеспечения Excel. Корреляцию уровня кортизола с изменением уровня экспрессии генов серотониновой системы проводили с помощью приложения GraphPad InStat3 по коэффициенту корреляции Пирсона.
ГЛАВА 3 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Серотонинергическая (СТ-ергическая) система - это совокупность взаимосвязанных нейронов, секретирующих в качестве трансмиттера серотонин (СТ), расположенных в переднем (ростральном) и заднем (каудальном) ядрах шва мозгового ствола и оказывающих тормозный эффект, вариабельность экспрессии генов данной системы во многом зависит от внешних факторов в том числе и стрессовых и внутренних процессов организма. Экспрессия генов серотониновой системы может послужить одним из многих цитогенетических маркеров, т. е. более или менее устойчивым признаком организма, по которому можно судить о вероятности проявления другой, трудно определяемой характеристики. Например, мы предполагаем, что стрессовые факторы могут влиять на многие медиаторные биохимические системы мозга, прежде всего на серотонинергическую, вызывая изменение уровня экспрессии гена переносчика серотонина и серотониновых рецепторов.
|
|
|


