 |
Выражения и расчёта концентрации
|
|
|
|
1.3.1 По роли в объемном анализе различают рабочий и анализируемый растворы.
Рабочий раствор – это раствор того вещества, по концентрации которого устанавливают концентрацию анализируемого раствора.
Растворы с известной концентрацией в весовом анализе называют титрованными, т.е. с известным титром.
Титр – один из способов выражения концентрации растворов, показывает, сколько г (или мг) растворенного вещества содержится в 1 мг раствора. Обозначается Т, измеряется в г/мл или мг/мл. Является одним из видов массовой концентрации.
1.3.2 По способу нахождения точной концентрации титрованные растворы делят на два типа:
а) приготовленные;
б) установленные.
Приготовленным раствором называется титрованный раствор, точная концентрация которого становится известной в процессе его приготовления по точной навеске, взятой на аналитических весах, и точному объему раствора:
T (A) = m (A)/V (A), г/мл
Навеску вещества рассчитывают заранее. Масса вещества, необходимая для приготовления заданного объема раствора, заданной концентрации (или масса вещества, содержащаяся в любом объеме раствора известной концентрации) прямо пропорциональна концентрации, молярной массе или молярной массе эквивалента растворенного вещества и объему раствора.
 г, мг;
г, мг;
 г, мг.
г, мг.
Кроме титра рабочего раствора
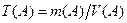 (г/мл)
(г/мл)
часто применяют в расчетах титр рабочего раствора вещества (А) по определяемому иону или веществу (Х).
Титр рабочего раствора по определяемому иону или веществу показывает, сколько г (мг) определяемого иона или вещества (Х) взаимодействует с 1 мл рабочего титрованного раствора вещества (А). Обозначается Т(А/Х). Например, Т(KMnO4/Fe2+) показывает, сколько г взаимодействует Fe2+ взаимодействует с 1 мл рабочего титрованного раствора KMnO4;
|
|
|
Т(AgNO3/Cl-) – титр рабочего раствора нитрата серебра по иону Cl-, показывает, сколько г Cl- взаимодействует с 1 мл рабочего титрованного раствора.
Титр Т(А/Х) вычисляется:
1) по затраченному на титрование объему рабочего раствора
 , г/мл,
, г/мл,
где m (Х)– масса титруемого иона или вещества, г
V (А)– эквивалентный объем рабочего раствора, мл
2) по концентрации рабочего титрованного раствора:
 ,
,
например:
 (г\мл)
(г\мл)
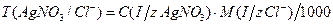 (г/мл)
(г/мл)
Вещества, пригодные для получения приготовленных растворов, называется исходным и должны удовлетворять следующим требованиям:
а) быть химически чистым,
б) иметь определенный химический состав, выражающийся одной формулой и не изменяющийся как при хранении веществ, так и при приготовлении раствора.
Круг таких веществ ограничен (поваренная соль; кристаллогидрат щавелевой кислоты, некоторые квасцы, бура и др.).
Большинство же веществ в той или иной мере изменяются со временем, поэтому для получения из них растворов с точной концентрацией вначале готовят раствор примерной концентрации, а затем устанавливают его точную концентрацию путем титрования.
Установленным раствором называется титрованный раствор, точная концентрация которого стала известной из расчетов по результатам титрования.
Расчет ведут на основании закона эквивалентов, который в применении к веществам, взаимодействующим в растворенном состоянии, можно сформулировать так: “Объемы растворов реагирующих веществ в точке эквивалентности обратно пропорциональны нормальным концентрациям этих веществ (или молярным концентрациям эквивалентов этих веществ)”. Для реакции
А + В → С + Д
где V (A), V (B) – объемы рабочего и анализируемого раствора в точке эквивалентности;
C (1/zA), C (1/zB)– нормальные концентрации рабочего и анализируемого раствора (или молярные концентрации эквивалентов этих веществ).
|
|
|
Нормальная или молярная концентрация эквивалентов показывает, какое количество вещества эквивалента содержится в единице объема раствора. Измеряется в моль/л, ммоль/мл.
Рекомендуется применять целые единицы измерения (моль/л), т.к. пропорциональные дробные величины численно с ними совпадают. Например, если имеется раствор с молярной концентрацией эквивалентов 0,1 моль/л, то его концентрация в ммоль/л также равна 0,1.
Нормальная концентрация (молярная концентрация эквивалента) находится отношением количества вещества эквивалента (n моль), содержащегося в растворе, к объему, этого раствора (V л).

или учитывая, что
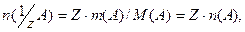
можно вычислить:


|
|
|


