 |
Определение степени гидролиза методом измерения рН раствора
|
|
|
|
Количественно реакция гидролиза оценивается величинами степени гидролиза h – долей электролита, подвергнувшейся гидролизу, и константы гидролиза Кг. Обе величины связанны следующим соотношением:
Кг = h2с / (1 - h) (9)
где с – молярная концентрация соли, моль/л.
В случае, когда степень гидролиза в растворе невелика (h < 0,01), при вычислениях пользуются приближёнными выражениями
Кг = h2с
или
h = 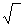 Кг/с, (10)
Кг/с, (10)
Если известны концентрации ионов водорода Δ[Н+] или гидроксида Δ[ОН-], образующихся за счёт реакции гидролиза, и исходная концентрация соли [МеА], то степень гидролиза рассчитываются hi с помощью следующих выражений:
h = Δ[Н+]/[МеА] (11),
h = Δ[ОН-]/[МеА] (12)
Обозначив концентрации ионов водорода в растворе соли [Н+]соли и в воде [Н+]Н2О, получим
Δ[Н+] = [Н+]cоли - [Н+]воды (13)
[Н+]соли и [Н+]Н2О можно рассчитывать, если известны величины рН в растворе соли и в воде, так как
рН = -lg[Н+] (14).
Пример: Предположим, значение рН для воды равно 6,5. Тогда lg[Н+] = -6,5. По данному логарифму находим число (антилогарифм), характеризующее концентрацию ионов водорода в воде: [Н+]Н2О = 3,2∙10-7 моль/л. Зная величину ионного произведения воды Кw
Кw = [Н+]∙[ОН-] = 10-14 (15),
рассчитывают
[ОН-] = 10-14/3,2∙10-7 = 3,1∙10-7 моль/л.
При рН раствора соли равном 2,8 lg[Н+] = -2,8. Концентрация ионов [Н+] в растворе соли будет
[Н+]соли = 1,6∙10-3 моль/л,
а Δ[Н+] = 1,6∙10-3 - 3,2∙10-3 = 1,59968∙10-3 моль/л.
Если исходная концентрация соли равна 0,1 моль/л, то степень гидролиза:
h = 1,9968∙10-3/0,1 = 1,6 %.
рН испытуемого раствора соли измеряется с помощью прибора рН-метра. Измерение рН основано на определении электродвижущей силы (э.д.с.) электрохимической цепи, состоящей из двух электродов. Потенциал электрода является логарифмической функцией концентрации ионов водорода:
|
|
|
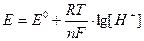
Следовательно, измерив величину э.д.с., можно определить величину рН исследуемого раствора.
Порядок работы.
Измерить величину рН раствора испытуемой соли (FeCl3, Na2CO3 и др.) и определить степень гидролиза этой соли.
Для этого сначала измерить на рН-метре рН дистиллированной воды, а затем рН испытуемой соли. Используя уравнение (14), рассчитать концентрацию ионов водорода (концентрацию ионов гидроксила рассчитывают по уравнению (15))в воде и в растворе соли, а затем по уравнению (13) рассчитать величину Δ[Н+]. По уравнению (11) (или (12) в случае щелочной среды) рассчитать степень гидролиза соли.
11 Лабораторная работа № 10
Метод комплексообразования. Трилонометрия. Определение общей
Жёсткости воды методом комплексонометрии
Сущность метода комплексообразования
Метод комплексообразования или комплексонометрическое титрование – один из методов объёмного химического количественного анализа аналитической химии, основан на применении в целях анализа реакции образования комплексных соединений при взаимодействии анализируемых ионов с некоторыми органическими реагентами, называемыми комплексонами.
В аналитической химии часто применяют комплексон – двунатриевую соль этилендиаминтетрауксусной кислоты
HOOCH2C CH2COOH
 |  |

 N ─ CH2 ─ CH2 ─ N
N ─ CH2 ─ CH2 ─ N
NaOOCH2C CH2COONa
Это вещество имеет другие названия: комплексон III, трилон Б.
При взаимодействии этого комплексона с ионами металлов образуются внутрикомплексные соединения (хелаты), например:
 О
О



 О О О
О О О






 С С
С С


 Cа2+
Cа2+

 Н2С CH2
Н2С CH2
 |  |

 N ─ CH2 ─ CH2 ─ N
N ─ CH2 ─ CH2 ─ N
NaOOCH2C CH2COONa
Комплексоны катионов металлов с трилоном Б, как правило, бесцветны и очень прочны, они могут образовываться даже, если первоначально ион-комплексообразователь связан в другой, менее прочный комплекс.
|
|
|
Метод комплексонометрии с использованием в качестве рабочего раствора трилона Б называют трилонометрией.
Применение метода трилонометрии для определения общей
Жесткости воды
В производственной практике комплексонометрическое титрование применяют для определения общей жесткости природной воды. Общая жесткость воды равна сумме количеств миллимоль – эквивалентов ионов кальция и магния, содержащихся в 1 л воды.
Для определения общей жёсткости к исследуемому объёму воды добавляют буферную смесь для создания щелочной среды (рН = 10) и раствор индикатора, например, эриохрома чёрного Т. Эриохром чёрный Т – органический азокраситель, диссоциирующий по типу кислоты, сокращенно его формулу можно представить как Н3Ind.
В растворе индикатора при рН = 7 – 11 устанавливается равновесие:
Н3Ind ↔ НInd 2- + 2 Н+
Этот индикатор с катионами Са2+ и Mg2+, образует винно-красные комплексные анионы, что можно схематично представить так:
Са2+ + НInd 2- → СаInd - + Н+
синий красный
Mg2+ + НInd 2- → MgInd - + Н+
синий красный
При титровании раствором трилона Б красные комплексы, как менее прочные, разрушаются, катионы кальция и магния переходят в более прочные бесцветные комплексы с трилоном Б, анионы же индикатора (синего цвета) освобождаются:
СаInd - + Na2[H2Yr] → Na2[CaYr] + НInd 2- + Н+ (16)
красный бесцвет. Бесцвет. синий
MgInd - + Na2[H2Yr] → Na2[MgYr] + НInd 2- + Н+ (17)
красный бесцвет. Бесцвет. Синий
В приведённых схемах:
Yr – символ этилендиаминтетраацетат-иона
-OOCH2C CH2COO-
 |  |

 N ─ CH2 ─ CH2 ─ N
N ─ CH2 ─ CH2 ─ N
-OOCH2C CH2COO-
НInd 2- - символ аниона индикатора, соответствующего его диссоциации в щелочной среде.
Из приведённых схем 1 и 2 видно, что в точке эквивалентности красная окраска раствора комплексов кальция и магния с индикатором сменяется синей окраской, которую придают раствору анионы индикатора.
|
|
|


