 |
Методы оценки функционального состояния печени
|
|
|
|
Бромсульфалеиновый тест.
Антипириновый тест. Основан на определении содержания антипирина (1-фенил-2,3-диметилпиразолон-5) в крови в разные промежутки времени после его внутривенного введения. Время полувыведения препарата в норме 2,6 часа. Как резкое снижение, так и повышение этого показателя может свидетельствовать об угнетении функции печени.
Клиренс индоцианина-зеленого. Клиренс индоцианина-зеленого менее 0,4 мг/кг/мин даже после экономных резекций печени связан с достоверно более высокой частотой острой печеночной недостаточности в послеоперационном периоде. Для больных, которым планируются обширные резекции печени, этот показатель должен быть не менее 1,0 мг/кг/мин).
Клиренс лидокаина. По количеству моноэтилгилинексилидида - основного метаболита лидокаина в крови и моче.
Радиоизотопное исследование поглотительно-выделительной функции печени. Осуществляется с помощью Brom Mesida, меченного радиоактивным технецием. Количество и скорость перехода радиофармпрепарата из крови в гепатоцитарный массив и обратно, из гепатоцитарного массива в желчь и обратно оценивается в цифровом выражении. Например, обобщенная оценка функционального состояния печени равна 10, что указывает на слабое изменение функционального потенциала и сохранение 65% резерва.
РКТ-волюметрия не пораженной опухолью печени имеет важнейшее значение, особенно когда при обширной резекции печени удаляется значительный объем не пораженной опухолью паренхимы печени. При этом максимальный уровень клиренса индоцианина-зеленого должен быть умножен на число (выраженное в %), получаемое из следующей формулы:
| объем резецированной печени - объем опухоли | х100% |
| общий объем печени - объем опухоли |
|
|
|
Наряду с оценкой функционального состояния паренхимы печени проводится изучение функционального состояния миокарда (по данным ЭКГ, эхокардиографии), функции внешнего дыхания (спирометрия), функции почек (радиоизотопное исследование секреторно-экскреторной функции почек), свертывающей системы крови (коагулограмма). В результате решения диагностических задач двух групп с высокой степенью вероятности можно судить, во-первых, о резектабельности процесса в печени, во-вторых, о прогнозе лечения и заболевания.
Необходимо помнить, что при очевидном диагнозе лабораторные данные неспецифичны. Повышение АФП непостоянно. В 20% случаев он выше 200 нг/мл, этот уровень является патогномоничным. Кроме случаев, когда присутствует острая стадия вирусного гепатита, тогда повышение АФП может быть очень значительным, в периоде регенерации печени, при герминогенных опухолях и беременности. В 20% случаев этот показатель нормален. В остальных случаях показатель промежуточный и соответствует тем, которые могут наблюдаться при хроническом течении гепатита либо цирроза.
Диагностика основывается на проведении УЗИ печени, во время которого возможно определить гипоэхогенные узлы и иногда выявить тромбоз портальной вены. Биопсия под контролем УЗИ позволяет подтвердить диагноз. Если уровень АФП>200 нг/мл, цитологическое исследование асцитической жидкости является бесполезным (при отсутствии карциноматоза брюшины). Поэтому биопсию можно не выполнять.
Для точной оценки масштабов поражения на фоне измененной печени очень информативным методом является МРТ. КТ с контрастированием имеет меньшее диагностическое значение, но позволяет выявить вовлечение сосудов.
Для оценки внепеченочного распространения опухоли выполняют рентгенографию грудной клетки и сцинтиграфию костей. Кроме того, необходимо оценить состояние нижней полой вены и надпеченочных сосудов.
|
|
|
При наличии известного хронического заболевания печени необходимо прилагать усилия для выявления рака печени на ранней стадии. Для этого необходимо каждые 4-6 месяцев повторять два исследования.
1. УЗИ печени. На ранней стадии рак появляется как маленький гипоэхогенный узел менее 3 см в диаметре.
2. Определение уровня АФП. Даже незначительное стабильное повышение концентрации АФП при повторных исследованиях говорит в пользу наличия рака печени.
Развитие и прогноз рака печени
В клинически очевидных случаях при больших опухолях прогноз неблагоприятный (одногодичная летальность приближается к 100%). Если рак проявился на фоне печеночной декомпенсации, прогноз зачастую неблагоприятный. Исход возникает на фоне печеночно-клеточной недостаточности или желудочно-кишечного кровотечения, поскольку только незначительное количество случаев поддается консервативному лечению. Часто на этой стадии уже существует массивный портальный тромбоз. Таким образом, важно и необходимо проводить максимально раннюю диагностику рака. Это основывается на определении факторов риска, основным из которых является цирроз.
Лечение рака печени
Основным радикальным методом лечения рака печени является хирургическое вмешательство, дающее шанс больному на значительное продление жизни. Такие операции должны выполняться с учетом анатомо-топографических особенностей печени в крупных специализированных хирургических центрах. Оперативное лечение главным образом зависит от размера опухоли, ее расположения и от состояния непораженных тканей печени (рис. 33, 34).
Пациенты с диффузным ПКР и с тяжелой формой цирроза обычно считаются неоперабельными. Принимая во внимание то, что у многих пациентов имеется цирроз печени, очень важно сохранить функционирующие ткани печени насколько это возможно, чтобы избежать послеоперационной печеночной недостаточности.
При небольших опухолях возможно выполнение экономных хирургических операций - удаления части печени с опухолью. При больших же опухолях возможно удаление больших объемов печени (до половины анатомической структуры органа) (рис. 34), функция печени при этом сохраняется.
|
|
|
После хирургического лечения более пяти лет живет до 40% больных, чего не было еще лет десять назад.
Резекция печени при наличии злокачественного образования в ней требует соблюдения двух взаимосвязанных условий:
1) необходимости достижения адекватного отступления линии рассечения печеночной паренхимы от края опухоли;
2) одновременно с этим постоянного контроля за кровотечением, особенно из печеночных вен и нижней полой вены.
Эти два положения являются краеугольным камнем в печеночной хирургии и должны доминировать в сознании хирурга над всеми другими моментами в течение всей операции. В идеале линия резекции должна отступать от края опухоли не менее чем на 1 см, однако при больших опухолях это условие соблюдать трудно, особенно при удалении больших опухолей, связанных с НПВ или печеночными венами в межсекторальных сосудистых границах, а также при локализации их вблизи ворот печени. Поскольку есть сообщения о длительном выживании больных при небольшом отступлении разреза от опухоли (менее 1 см), данное обстоятельство не должно сдерживать хирурга. По мнению ряда авторов, любой микроскопически чистый край резекции следует считать адекватным.
а  б
б 
в 
Рис. 33. Анатомо-топографические особенности печени.
а – доли печени, б – сегменты печени, в – связки печени. По Castaing D. et al.

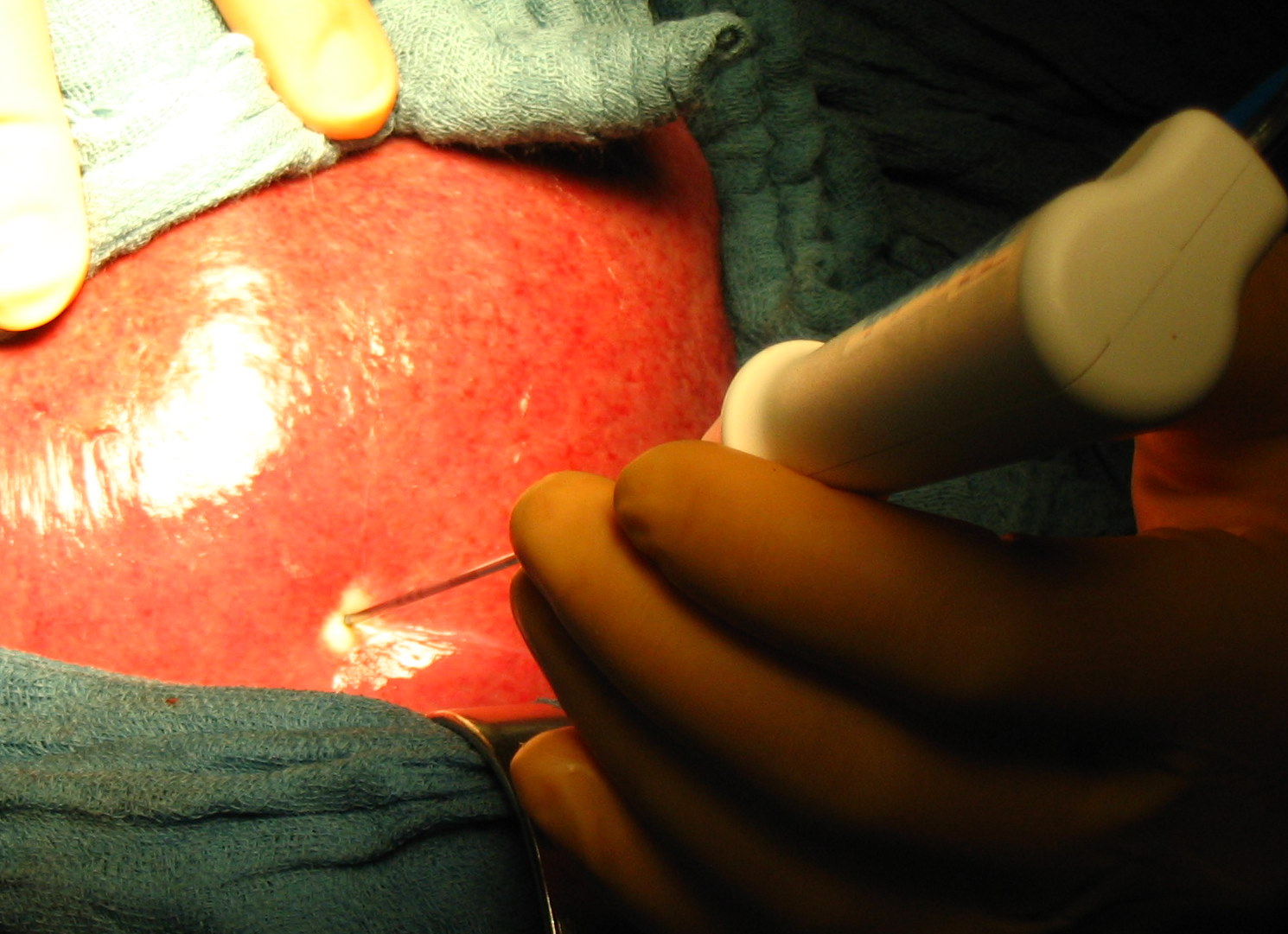
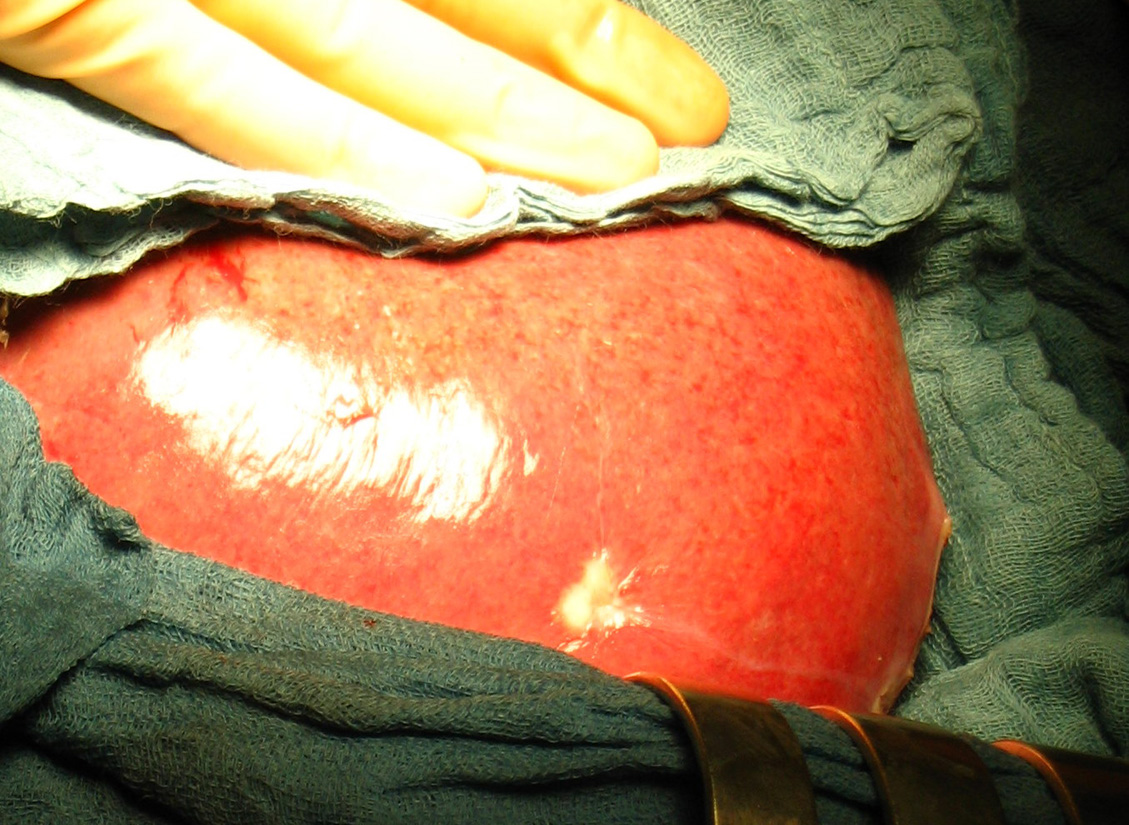
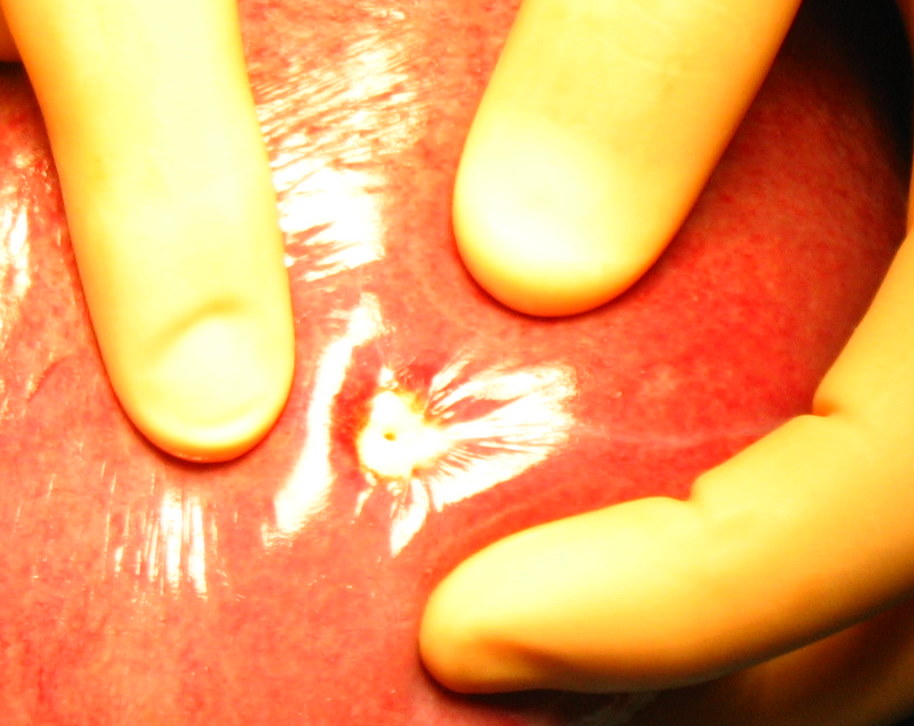
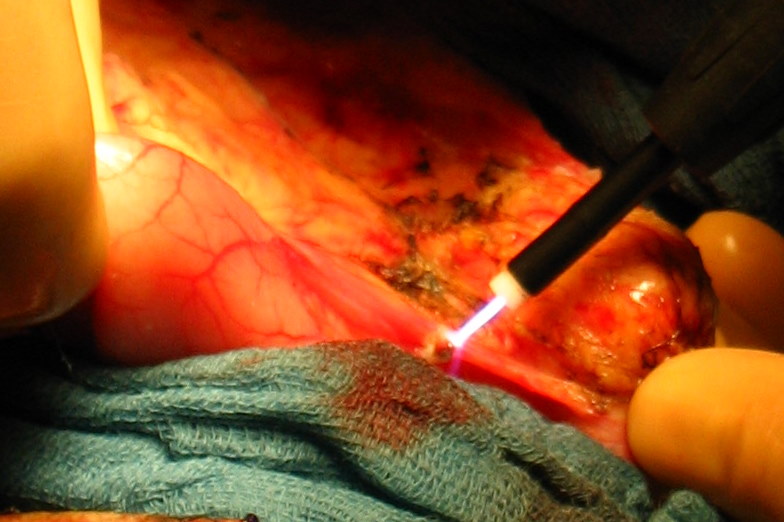

Рис. 34. Различные этапы резекции печени с использованием радиочастотной термоабляции и плазменного скальпеля, позволяющего максимально полно остановить паренхиматозное кровотечение при минимальной травматизации ткани печени.
Для контроля за кровотечением прежде всего необходимо точное знание хирургической анатомии печени. Но поскольку строение ворот печени, расположение трубчатых структур ее, характер впадения печеночных вен имеют значительные индивидуальные вариации, для их определения в каждом конкретном случае следует прибегать не только к тщательному предоперационному обследованию (ангиография, портография и т.п.), но и применению интраоперационной ультразвуковой томографии. Последний метод особенно важен, т.к. позволяет не только уточнить распространенность опухолевого процесса, но и индивидуализировать особенности сосудистой архитектоники печени, установить отношение опухоли к крупным венозным сосудам.
|
|
|
Другим способом контроля за кровотечением является выполнение ряда технических приемов. Самым важным и наиболее часто применяемым является пережатие структур гепатодуоденальной связки с помощью петли (так называемый Pringle-маневр) (рис. 35). Безусловно, безопасная длительность пережатия сосудов составляет 15-20 минут, хотя в литературе описана и более длительная окклюзия - до 70 минут, правда, при отсутствии цирроза печени.
В 1974 году J. Fortner et al. для профилактики кровотечений при обширных резекциях предложили способ полной сосудистой изоляции печени, заключающийся в окклюзии сосудов ворот печени, пережатии нижней полой вены (НПВ) над и под печенью и гипотермической перфузии печени (рис. 36). Время общей печеночной ишемии при этом способе может достигать 90 минут. Хотя этот метод имеет немало сторонников, он довольно сложен и требует большого количества жидкости для перфузии. Даже сам автор признает, что метод не может использоваться рутинно.
Более проста и, следовательно, чаще применима модифицированная техника общей печеночной окклюзии без перфузии гипотермических растворов. Она показана при повреждении НПВ или печеночных вен, во избежании циркуляторных расстройств вследствии отсутствия поступления крови в сердце из НПВ длительность ее проведения не должна превышать 10 мин. Данный способ применим при правосторонней гемигепатэктомии и при резекции VIII сегмента.

Рис. 35. Пережатие структур гепатодуоденальной связки. По Castaing D. et al.

Рис. 36. Полная сосудистая изоляция печени. По Castaing D. et al.
Бескровному оперированию помогает использование специальной хирургической техники: ультразвукового дезинтегратора, в том числе и отечественного (Нижний Новгород), гармонического скальпеля, водоструйного, плазменного скальпеля, аргонового коагулятора, специальных клеящих материалов (тахокомб), двухкомпонентного фибринового клея (рис. 37, 38). Однако широкое их внедрение ограничено из-за высокой стоимости.

Рис. 37. Установка для ультразвуковой дезинтеграции ткани печени.
а 

б 

в 

г 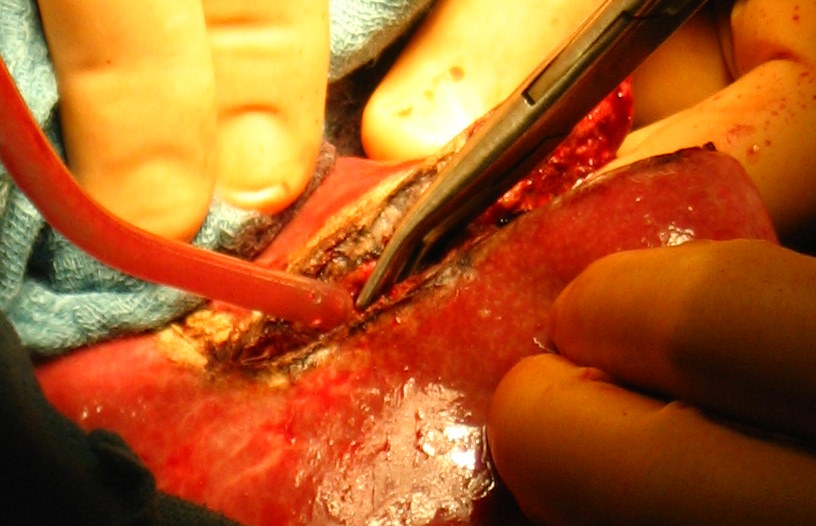

д 

Рис. 38. Различные этапы атипичной резекции печени.
а - определение места локализации опухоли и поверхностное рассечение ткани печени;
б - введение в зону операционной раны отсоса; в и г - полное рассечение печени с одной стороны удаляемого сегмента; д - окончательное удаление сегмента.
|
|
|
Выделяют следующие оперативные вмешательства:
1) обширные резекции печени (право- и левосторонняя гемигепатэктомия простая и расширенная) (рис. 39),
2) сегментарные резекции печени (чаще всего IV сегмент, II и III сегменты, VIII сегмент, VI-VII сегменты, редко I сегмент)
3) атипичные резекции печени (любое сочетание сегментов, краевые резекции) (рис. 38). Последний вид операции производится крайне редко.
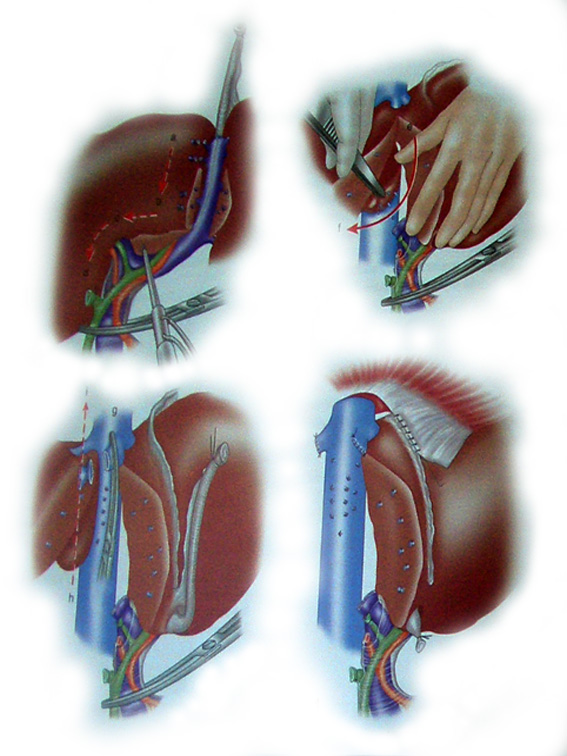
Рис. 39. Обширные резекции печени.
По Castaing D. et al.
Видом хирургического лечения является трансплантация печени, которая при наличии большой опухоли является неэффективной из-за частых рецидивов. Напротив, существуют очень хорошие результаты при наличии маленького узла (<3 узлов <3 см или один узел <5 см).
Полное удаление опухоли или трансплантация (пересадка) печени дают наилучший шанс на выздоровление больного. К сожалению, в большинстве случаев полное удаление опухоли бывает невозможным. Часто опухоль бывает очень больших размеров, поражает несколько участков органа или выходит за пределы печени. Кроме того, у многих больных циррозом не остается достаточного количества нормальной печеночной ткани для выполнения полноценной операции.
а 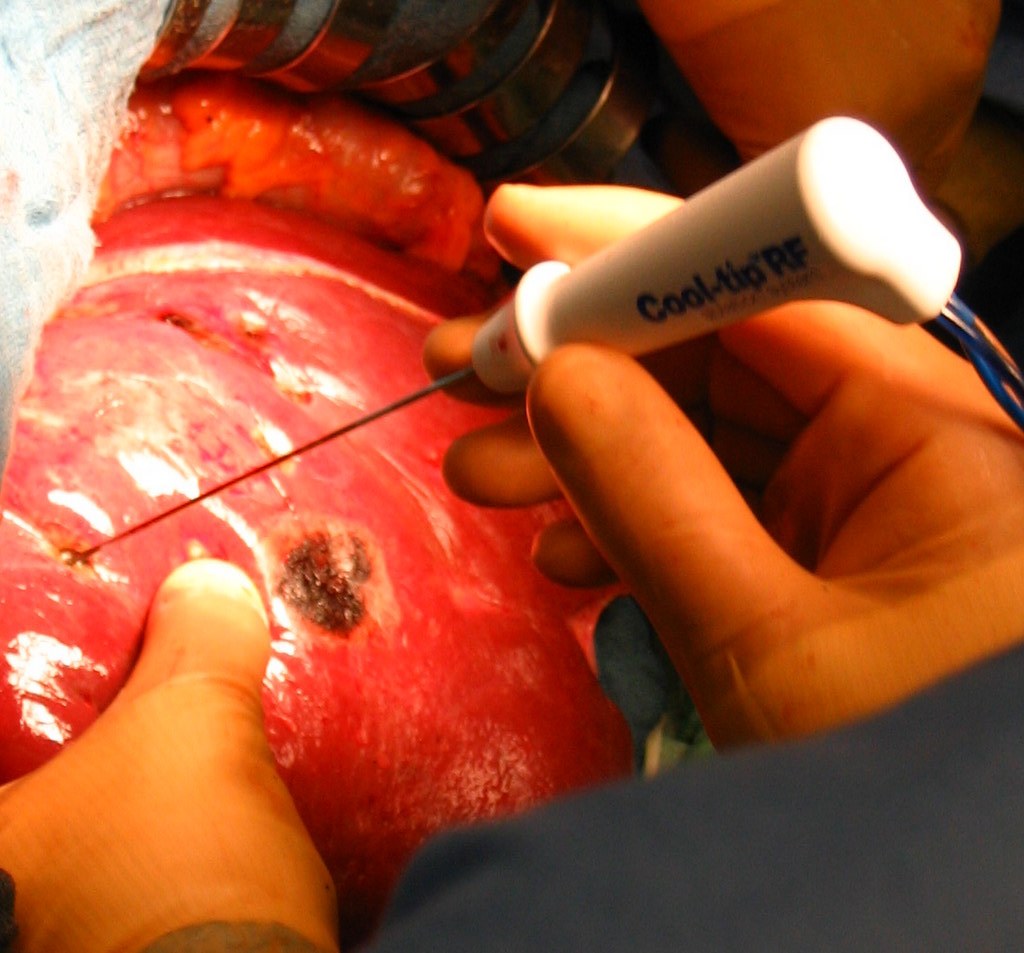

б 

в 

Рис. 40. Ключевые этапы радиочастотной термоабляции.
а - введение зонда и деструкция поврежденной ткани печени; б - удаление коагулированной ткани с помощью отсоса; в - резекция фрагмента печени.
При раке этого органа трансплантация печени используется редко. Такая операция показана больным с небольшими множественными опухолевыми узлами, которые нельзя полностью удалить. Кроме того, трудно найти подходящего донора для трансплантации, на что требуется время.
Больным, у которых невозможно выполнение хирургического вмешательства, применяются лекарственные и паллиативные методы лечения, направленные на увеличение продолжительности жизни и уменьшение местных симптомов.
Химиоэмболизация. Используется липидол как антимитотический вектор. Это вызывает хороший местный эффект.
Алкоголизация. Внутриопухолевое введение чистого спирта. Эффективно при наличии маленьких опухолей, но требует проведение повторных сеансов.
Радиочастотная абляция. Метод основан на тепловом разрушении опухолевого очага. Под контролем КТ, УЗИ, лапароскопически либо открытым способом (рис. 40). На сегодняшний день представляет собой перспективный метод лечения, находящийся на стадии изучения.
Лучевая терапия. С помощью данного метода можно сократить размеры или уничтожить опухоль. При этом нельзя использовать очень высокие дозы, так как в этом случае погибнет и нормальная ткань печени. В ряде случаев лучевая терапия применяется для уменьшения интенсивности симптомов, например боли. Этим методом нельзя полностью излечить больного раком печени. В настоящее время изучается возможность применения облучения в сочетании с химиотерапией для улучшения результатов лечения.
Химиотерапия. Рак печени обычно не реагирует на большинство противоопухолевых препаратов. Наиболее эффективными препаратами считаются доксорубицин и цисплатин, однако они не продлевают жизнь больных. Некоторые полагают, что введение противоопухолевых препаратов в печеночную артерию может улучшить результаты лечения. Не существует общей химиотерапии, доказавшей свою эффективность.
Назначение какого-либо конкретного способа лечения должно основываться на общем состоянии больного, стадии опухолевого процесса. При тяжелой степени печеночно-клеточной недостаточности (цирроз Child С) или полного тромбоза портальной вены ни один из способов лечения не может быть применен.
Алгоритм лечения рака поджелудочной железы представлен в виде схемы 3.
3.12. Выживаемость при раке печени
Если рак печени выявлен на ранней стадии, то с помощью операции больного можно полностью излечить. В этом случае вероятность 5-летней выживаемости составляет 30-40%. Однако таких больных мало, а общая 5-летняя выживаемость у больных раком печени составляет всего 7%.
Схема 3. Лечение гепатоцеллюлярного рака на фоне цирроза печени
(принципы лечебных мероприятий во Франции)
| Локализованная опухоль и гистологический коэффициент < 2 |
| 1 узел > 5 см либо более 3 узлов |
| Медикаментозное либо внутриартериальная терапия – химиоэмболизация |
| Узел < 5 см, либо менее 3 узлов < 3 см |
| оценить возможность трансплантации |
| трансплантация печени |
| Невозможность выполнить трансплантацию Хирургическая резекция, местное лечение (спирт, криотерапия, радиочастотная термоабляция) либо внутриартериальная терапия |
| Поздние стадии опухоли (>50% паренхимы поражено, наличие метастазов, опухолевый тромбоз портальной вены) Плохое состояние оставшейся паренхимы органа (коэффициент 3-4) |
| Симптоматическая терапия Клинические исследования |
| Профилактика: - лечение вирусных гепатитов В и С - вакцинация против вирусного гепатита В - наблюдение пациентов с циррозом на предмет гепатоцеллюлярного рака Во всех случаях: - лечение пациентов с циррозом и его осложнениями - клиническое и параклиническое наблюдение |
  | |||
 | |||
|
|
|


