 |
Периодическая система элементов Менделеева
|
|
|
|
Попытаемся теперь понять, почему химические свойства атомов периодически повторяются с ростом номера химического элемента, т.е. при увеличении заряда его ядра. (Напомним, что номер элемента в таблице Менделеева совпадает с количеством протонов в его ядре и его зарядом).
В атоме водорода имеется один электрон в  состоянии. Электронная конфигурация описывается выражением
состоянии. Электронная конфигурация описывается выражением 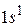 . Квантовые числа для атома имеют значения:
. Квантовые числа для атома имеют значения:
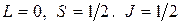 .
.
Основным термом будет терм 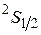 .
.
В атоме гелия имеются 2 электрона и его электронная конфигурация имеет вид 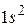 . Два электрона могут находится в
. Два электрона могут находится в  состоянии только при условии, что их спиновые квантовые числа отличаются, т.е. имеют значения
состоянии только при условии, что их спиновые квантовые числа отличаются, т.е. имеют значения 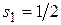 и
и  , так, что атом характеризуется набором квантовых чисел
, так, что атом характеризуется набором квантовых чисел
 ,
,
И основной терм атома гелия имеет вид 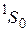
В атоме лития имеется три электрона. Два занимают К -оболочку, а третьему размещаться на ней запрещено принципом Паули, поэтому в состоянии с минимальной энергией (основном) третий электрон находится в 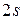 состоянии. Такую электронную конфигурацию можно описать как
состоянии. Такую электронную конфигурацию можно описать как 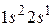 . Электроны полностью заполненной К -оболочки не дают вклада в момент импульса атома, который совпадает с моментом импульса валентного электрона. Набор квантовых чисел атома лития в основном состоянии имеет вид
. Электроны полностью заполненной К -оболочки не дают вклада в момент импульса атома, который совпадает с моментом импульса валентного электрона. Набор квантовых чисел атома лития в основном состоянии имеет вид
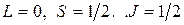 ,
,
А основной терм 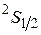 . Электрон в
. Электрон в 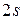 состоянии связан с ядром гораздо слабее по сравнению с электронами К -оболочки, поскольку его энергия в атоме намного больше. Этим и определяется высокая химическая активность лития, связанная со способностью легко отдавать валентный электрон для участия в химических соединениях.
состоянии связан с ядром гораздо слабее по сравнению с электронами К -оболочки, поскольку его энергия в атоме намного больше. Этим и определяется высокая химическая активность лития, связанная со способностью легко отдавать валентный электрон для участия в химических соединениях.
В атомах бериллия имеется 2 электрона в 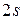 состоянии, спины которых противоположны. Электронная конфигурация имеет вид
состоянии, спины которых противоположны. Электронная конфигурация имеет вид 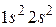 . Подоболочка
. Подоболочка 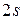 оказывается полностью заполненной. Поэтому в атомах следующих элементов (бор, углерод, азот, кислород, фтор, неон) появляются электроны в состоянии
оказывается полностью заполненной. Поэтому в атомах следующих элементов (бор, углерод, азот, кислород, фтор, неон) появляются электроны в состоянии 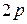 . В атоме неона L -оболочка оказывается полностью заполненной. Электронная конфигурация имеет вид
. В атоме неона L -оболочка оказывается полностью заполненной. Электронная конфигурация имеет вид 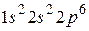 . Атомы с полностью заполненной электронами оболочкой очень устойчивы к внешним воздействиям, не вступают в химические реакции и являются инертными газами. В атоме фтора не хватает одного электрона до заполнения оболочки, и его высокая химическая активность связана со «стремлением захватить» недостающий электрон, понизить при этом сою энергию, оказавшись в устойчивом энергетическом состоянии.
. Атомы с полностью заполненной электронами оболочкой очень устойчивы к внешним воздействиям, не вступают в химические реакции и являются инертными газами. В атоме фтора не хватает одного электрона до заполнения оболочки, и его высокая химическая активность связана со «стремлением захватить» недостающий электрон, понизить при этом сою энергию, оказавшись в устойчивом энергетическом состоянии.
|
|
|
В атоме натрия начинает заполняться M -оболочка оболочка. Очередной добавленный в атом электрон занимает 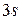 состояние и оказывается в условиях, аналогичных электрону лития в
состояние и оказывается в условиях, аналогичных электрону лития в 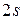 состоянии. Соответственно оба эти элемента оказываются щелочными металлами.
состоянии. Соответственно оба эти элемента оказываются щелочными металлами.
Таким образом, периодическая повторяемость химических свойств элементов с ростом их номера является следствием принципа запрета Паули.
Рентгеновские спектры
 Напомним, что широко используется тормозное рентгеновское излучение, возникающее в рентгеновской трубке при бомбардировке ее электронами достаточной энергии. Это излучение имеет сплошной спектр, в нем присутствуют (за исключением особенностей) все длины волн.
Напомним, что широко используется тормозное рентгеновское излучение, возникающее в рентгеновской трубке при бомбардировке ее электронами достаточной энергии. Это излучение имеет сплошной спектр, в нем присутствуют (за исключением особенностей) все длины волн.
Если энергия бомбардирующих антикатод (анод) электронов достаточно высока для вырывания электронов из внутренних, заполненных оболочек атома, то кроме тормозного рентгеновского излучения в спектре излучения появляются резкие линии, которые называют характеристическим излучением. Частоты этих линий зависят от материала антикатода, почему и называют излучение характеристическим. Оно излучается при переходах электронов с внешних оболочек на место электрона, выбитого из атома. Структура заполненных электронных оболочек у различных атомов похожа. Отличие заключается только в величине энергии связи электронов с ядром. Поэтому с ростом номера элемента частоты, излучаемые при запонении вакантных мест на внутренних оболочках закономерно растут, а структура возникающих серий линий у различных атомов похожа.
|
|
|
|
|
|


