 |
3. Материалы для самоподготовки к усвоению данной темы.
|
|
|
|
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки.
1. Что понимают под термином «коллигативные свойства растворов»? Какие это свойства?
2. Что такое идеальный раствор? К каким растворам применим данный термин приближенно?
3. Какие формулировки закона Ф. М. Рауля вы знаете? Какова их математическая форма записи?
4. Какие два следствия вытекают из закона Рауля? Их формулировки и математическая форма записи? Для каких систем их можно применить?
5. Что называется температурой кипения? Температурой замерзания (плавления)? Депрессией? Повышением температуры кипения?
6. Каков физический смысл эбуллиоскопической и криоскопической констант? От каких факторов они зависят? Единицы измерения?
7. Что называют осмосом? Приведите примеры осмоса, имеющее место в природе.
8. Что такое осмотическое давление? Осмометрия?
9. Сформулируйте закон Я. Вант-Гоффа для осмотического давления. Его математическая форма записи?
10. Что называется изотоническим, гипер- и гипотоническим раствором? Что такое цитолиз (лизис) и плазмолиз?
11. В чем смысл изотонического коэффициента Вант-Гоффа? Как его можно определить экспериментально и как рассчитывают теоретически?
12. Что такое осмоляльность и осмолярность? Изоосмия? Какова ее роль в общем гомеостазе для организма человека?
4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
6. Оснащение рабочего места.
6. 1. Дидактический материал: справочник физико-химических величин.
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: Термометр, прибор для измерения температуры плавления, спиртовка, капиллярная трубка (на группу)
|
|
|
6. 4. Объекты исследования: камфора, бензойная кислота (на группу)
7. Содержание занятия.
7. 1. Образец билета входного контроля.
1. К коллигативным свойствам раствора относятся:
А. Осмотическое давление; Б. Понижение температуры замерзания;
В. Молярная масса; Г. Повышение точки кипения;
Д. Изменение плотности; Е. Понижение давления паранад раствором.
2. Математическими выражениями закона Ф. М. Рауля являются:
А. Росм=RCT; Б. Pi=PoXi; В. DTз=KкрCm;
Г. X1=n1/Sni; Д. (Po-P1)/Po=X2; E. i=1+α ·(n-1).
3. Размерность эбуллиоскопической константы:
А. º К; Б. º К л/моль; В. º К·кг/моль;
Г. г/мл; Д. кПа; Е. Дж/(моль∙ º К).
4. Криоскопическая константа зависит лишь от:
А. Концентрации растворенного вещества;
Б. Температуры;
B. Природы растворенного вещества;
Г. Природы растворителя;
Д. Атмосферного давления;
Е. Влажности окружающей среды.
5. Найдите верное утверждение:
А. Раствор и растворитель кипят при одинаковой температуре;
Б. Раствор всегда замерзает при более высокой температуре, чем чистый растворитель;
В. Давление насыщенного пара над раствором меньше, чем давление насыщенного пара над чистым растворителем;
Г. Давление насыщенного пара над раствором не зависит от концентрации раствора;
Д. Закон Рауля применим к любым растворам.
6. Причиной осмоса является:
А. Наличие полупроницаемой мембраны;
Б. Градиент концентрации растворителя по разные стороны полупроницаемой мембраны;
В. Возникновение осмотического давления;
Г. Отличие давления раствора от атмосферного давления;
|
|
|
Д. Различие в природе растворителя и растворенного вещества.
7. 2. Узловые вопросы, необходимые для усвоения темы занятия:
1. Идеальный и реальный растворы. Коллигативные свойства растворов.
2. Закон Ф. М. Рауля и его следствия.
3. Закон Вант-Гоффа для осмотического давления.
4. Изотонический коэффициент, его смысл.
5. Осмолярность и осмоляльность. Изоосмия для биологических жидкостей.
7. 3. Самостоятельная работа обучающихся.
7. 3. 1. Лабораторная работа.
Задание. Определение температуры плавления раствора веществав камфаре.
Так как камфара плавится при 179˚ С, охлаждающей смеси не нужно. Значение криоскопической постоянной камфары составляет 40, так что понижения температур плавления, создаваемые веществами, велики и могут быть измерены обычным термометром.
Выполнение: смесь, состоящую из 0. 05 г бензойной кислоты и 0, 5 г камфары, гомогенизируют плавлением. После охлаждения часть твердой смеси перенесите в капилляр и определите температуру плавления.
Молярную массу кислоты рассчитывайте по формуле
М=(1000∙ mв-ва∙ К) / (∆ tплав∙ mр-ля), г/моль.
7. 3. 2. Задачи для самостоятельной работы.
1. Величины эбуллиоскопической и криоскопической констант для некоторых растворителей
| Растворитель | Еэб, оК кг/моль | Ккр, оК кг/моль |
| Вода Этанол Бензол Диэтиловый эфир Диоксан Уксусная кислота Хлороформ | 0, 52 1, 22 2, 57 2, 02 3, 20 2, 93 3, 63 | 1, 86 1, 99 5, 12 1, 73 4, 71 3, 90 4, 68 |
2. Разбор типовых задач
1. Вычислите температуру замерзания водного раствора рибозы с массовой долей 2%
Решение. Рибоза – неэлектролит, поэтому согласно уравнению DТзам=Ккр∙ Сm, где Ккр(Н2О)=1, 86 Ккг/моль, найдем моляльную концентрацию 2% раствора рибозы
Сm= 
Для 2%-ного раствора а=2, b=98, М(С5Н10О5)=150 г/моль.
ТогдаСm=0, 136 моль/кг.
Депрессия будет DТзам=1, 86 Ккг/моль × 0, 136 моль/кг = 0, 253о К.
Откуда Тзамерзания раствора=Тзамерзания воды - DТзам=0о С – 0, 253о С = -0, 253о С
Ответ: Тзамерзания раствора = -0, 253о С
2. Вычислите молярную массу неэлектролита, если известно, что температура кипения раствора, содержащего 1 г этого вещества в 20 г диоксана, равна 101, 9о С, а температура кипения чистого диоксана равна 100, 8о С.
|
|
|
Решение: Для неэлектролита согласно следствию из закона Рауля имеем:
DТкип=Еэб∙ Сm,
где Еэб для диоксана равна 3, 2
DТкип= Траствора – Тдиоксана =101, 9 – 100, 8 = 1, 1о К,
тогда
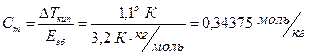
Согласно соотношению

имеем:
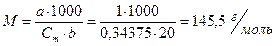
Ответ: Мнеэлектролита = 145, 5 
|
|
|


