 |
и непредельных жирных кислот с четным числом
|
|
|
|
и непредельных жирных кислот с четным числом
углеродных атомов
Окисление жирных кислот осуществляется с целью трансформации выделившейся при этом энергии в энергию макроэргических связей АТФ. Исходя из этого, биохимиков больше интересует не вся энергия, а та её часть, которая реализуется в синтезируемых молекулах АТФ. Расчет биоэнергетики окисления жирной кислоты можно вести путем алгебраического сложения всех образовавшихся и использованных молекул восстановленных коферментов, выражая их в эквивалентах АТФ, а также участвующих в реакциях нуклеозидтрифосфатов. Для такого расчета необходимо написать все реакции метаболических путей окисления, что требует хорошего знания этих реакций и массу времени для расчета. Этот процесс можно упростить, используя математическое моделирование процессов.
Для выведения уравнения можно использовать формулу 1. В менее выраженной форме её элементы имеются у А. Ленинджера.
n = m/2∙ 10 + (m/2 – 1)∙ 4 – 2. (1)
Где n – количество запасаемых эквивалентов АТФ; m – количество углеродных атомов в жирной кислоте; m/2 – количество молекул ацетил-КоА образуемых в процессе β -окисления; 10 – количество эквивалентов АТФ образуемых при окислении ацетил-КоА в цикле Кребса (3НАДН + 3Н+, 1 ФАДН2, 1 ГТФ); (m/2 – 1) – число этапов β -окисления; 4 – количество эквивалентов АТФ запасаемых на каждом этапе (1 НАДН + Н+, 1 ФАДН2); 2 – количество эквивалентов АТФ потраченное на активирование жирной кислоты.
Решение уравнения 1 приводит к выражению 2
n = 7m – 6. (2)
Используя уравнение 2 можно рассчитать биоэнергетику окисления предельной, жирной кислоты с четным числом углеродных атомов от С4 и более. В случае расчета биоэнергетики окисления непредельной, жирной кислоты уравнение 2 преобразуется в следующее выражение
|
|
|
n = 7m – 1, 5 a – 6. (3)
Где «a» количество двойных связей в жирной кислоте. Уравнение 3 универсально для расчета биоэнергетики предельных и непредельных, жирных кислот с четным числом углеродных атомов, так как при «а» равном нулю выражение возвращается к уравнению 2.
Водный баланс окисления предельных жирных кислот с четным числом углеродных атомов
В процессе окисления жирной кислоты используются и образуются молекулы воды, при этом количество образовавшейся воды превышает её использование. Как и в случае расчета биоэнергетики окисления жирной кислоты можно идти двумя путями: написать все реакции пути и подсчитать алгебраическую сумму или вывести общее уравнение. Исходя из схемы окисления жирной кислоты (рис. 1) видно, что 1 молекула воды тратится на каждом этапе β -окисления и две молекулы в цикле Кребса при окислении ацетил-КоА, а образуется она в ЦПЭ и окислительном фосфорилировании. Первоначальное уравнение для подсчета водного баланса окисления жирной кислоты будет
Н2Омет. ЖК = [(m/2 – 1)∙ 4 + (m/2 – 1)∙ (2) + (m/2 – 1)∙ (-1)] + [m/2∙ 9 + m/2∙ 4 – m/2∙ 2] – 1, 5a (4),
где Н2Омет. ЖК – алгебраическая сумма использованной и выделенной в реакциях воды (мет. – метаболическая); ЖК – жирная кислота; m – количество углеродных атомов жирной кислоты; (m/2 – 1) – число этапов β - окисления; (m/2 – 1)∙ 4 – количество молекул Н2О полученных при окислительном фосфорилировании за счет НАДН + Н+ и ФАДН2 полученных на каждом этапе β -окисления; (m/2 – 1)∙ (2) – количество молекул Н2О полученных за счет электронов и протонов от НАДН + Н+ и ФАДН2 полученных на этапе β -окисления поступивших в ЦПЭ; (m/2 – 1)∙ (-1)– количество молекул воды используемых на каждом этапе β -окисления в еноил-КоА-гидратазной реакции; [(m/2 – 1)∙ 4 + (m/2 – 1)∙ (2) + (m/2 – 1)∙ (-1)] – баланс воды за счет этапов β -окисления; (m/2∙ 9) – количество молекул воды полученных за счет 3НАДН + 3Н+ и ФАДН2 при окислении ацетил-КоА в цикле Кребса (окислительное фосфорилирование); m/2∙ 4 – количество молекул воды полученных в ЦПЭ за счет 3НАДН + 3Н+ и ФАДН2; m/2∙ 2 – количество молекул воды затраченных в цикле Кребса; a - количество двойных связей в жирной кислоте; [m/2∙ 9 + m/2∙ 4 – m/2∙ 2] – количество молекул Н2О образующихся за счет ацетил-КоА.
|
|
|
Преобразование приведенного выше уравнения приводит к выражению
Н2Омет. ЖК = 8m – 1, 5a – 5. (5)
Водный баланс окисления пальмитиновой кислоты рассчитанный с использованием полученного уравнения равен 123 молекулам воды.
На следующем рисунке представлена схема полного окисления пальмитата.
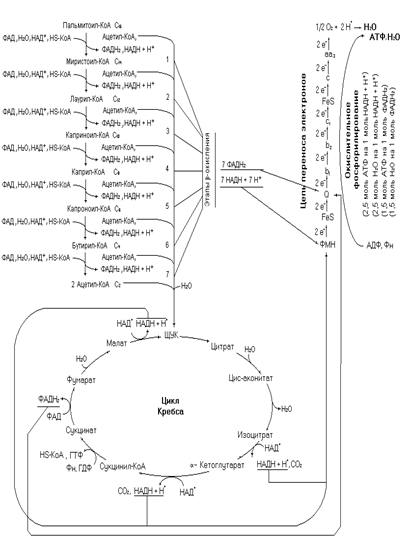
Рис. 13. Полное окисление пальмитоил-КоА.
Катаболизм жирных кислот с нечетным
числом углеродных атомов
Окисление жирных кислот с нечетным числом углеродных атомов осуществляется в матриксе митохондрий, включает стадии активирования, β – окисления, синтез сукцинил-КоА, цикл Кребса, цепь переноса электронов, окислительное фосфорилирование. Реакции β – окисления продолжаются до образования пропионил-КоА из которого синтезируется сукцинил-КоА. Реакции этого процесса представлены окислением гептановой кислоты до промежуточных продуктов цикла Кребса на рис. 14
|
|
|


