 |
«Получение этилена и изучение его свойств»
|
|
|
|
2. Напишите структурные формулы: а) 2-метилгексана, б) 2, 2- диметилпентана, в) 2-метилбутана, г) 2, 3, 5 –триметилгексана, д) 3, 3 –диметилгексана, е) 2, 4 – диметил-3- этилоктана. Для вышеперечисленных веществ составьте структурные формулы: а) гомологов с менее длинной углеродной цепью; б) изомеров. Назовите их.
| Структурные формулы. | Гомологи с менее длинной углеродной цепью: | Изомеры: | |
| а) 2-метилгексан |
Продолжение задания 2
| Структурные формулы. | Гомологи с менее длинной углеродной цепью: | Изомеры: | |
| б) 2, 2- диметилпентан | |||
| в) 2-метилбутан | |||
| г) 2, 3, 5 –триметилгексан | |||
| д) 3, 3 –диметилгексан | |||
| е) 2, 4 – диметил-3- этилоктан |
Контрольные вопросы
1. Какие углеводороды относятся к алканам?
2. Что такое радикал? Каким образом складывается название радикалов?
3. Дайте определение изомеров. Приведите примеры изомеров.
4. Перечислите сходства гомологов ряда метана (алканов).
5. Основные правила составления названия алканов (основы международной номенклатуры).
Лабораторное занятие №6
«Получение этилена и изучение его свойств»
Цель: закрепление знаний о свойствах непредельных углеводородов: способности алкенов вступать в реакции присоединения, окисления, горения; изучение качественных реакций на непредельные углеводороды.
Теория
Этилен - С2Н4 является простейшим представителем непредельных углеводородов с одной двойной связью: СН2 = СН2.
Получение.
1. В промышленности этилен выделяют из газов крекинга (расщепления) нефти. Важнейший способ получения этилена - дегидрирование этана над никелевым катализатором:
|
|
|
СН3 – СН3 ® СН2=СН2 + Н2
2. В лаборатории получают дегидратацией этилового спирта (отщепление воды). Воздействие водоотнимающих средств (конц. Н2SO4) на одноатомные спирты при высокой температуре, приводит к отщеплению молекулы воды и образованию двойной связи:
СН3 – СН2ОН ® СН2=СН2 + Н2О
В создании двойной связи между двумя атомами углерода участвуют две пары электронов, причем одна связь – прочная, а другая связь слабая, легко разрывается, что и объясняет ненасыщенных характер органических соединений с двойной связью и сказывается на их химических свойствах.
I. Так, для непредельных углеводородов ряда этилена характерны реакции присоединения, которые протекают с разрывом двойной связи.
1. Реакция гидрирования: СН2=СН2 + Н2 ® СН3 - СН3
2. Реакция галогенирования: СН2=СН2 + Вr2 ®СН2Вr - СН2Вr
При взаимодействии с алкенами бромная вода обесцвечивается, поэтому реакция с бромной водой является качественной на непредельные углеводороды.
3. Реакция гидрогалогенироеания: СН3 — СН=СН2 + НВr ® СН3 – СНВr - СН3
Присоединение галогеноводородов к алкенам происходит по правилу Марковникова: атом водорода присоединяется к более гидрированному атому углерода (при котором больше содержится атомов водорода), а галоген - к менее гидрированному атому углерода.
4. Реакция гидратации: этен, присоединяя воду, образует этиловый спирт.
СН2=СН2 + Н2О® СН3 – СН2ОН
II. Реакции окисления
1. Реакция горения: алкены горят с образованием углекислого газа и воды.
С2Н4 + 3О2 ® 2СО2 + 2Н2О
2. Реакция окисления: этилен окисляются водным раствором КМnO4 до
этиленгликоля:
СН2=СН2 + [О] + НОН ® СН2ОН – СН2ОН
Реакция с КМnO4 является качественной реакцией на непредельные углеводороды, т. к. фиолетовый раствор перманганата калия в ходе реакции обесцвечивается.
|
|
|
III. Реакции полимеризации.
7. Реакция полимеризации протекает за счет разрыва кратных связей, с
образованием высокомолекулярного соединения (полимера).
nСН2=СН2 ® (-СН2-СН2-)n
Порядок выполнения работы
Оборудование и реактивы: лабораторный штатив; спиртовка; три пробирки; пробка с газоотводной трубкой; прокаленный песок или кусочек пемзы; смесь этилового спирта и концентрированной серной кислоты (1: 2); подкисленный раствор перманганата калия.
Опыт №1. Получение этилена
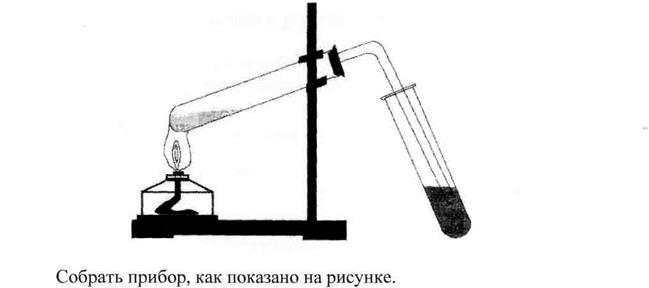
Налить в пробирку 10-15 мл смеси этилового спирта с концентрированной серной кислотой. Для равномерного кипения прибавить в смесь около 0, 5 г прокаленного речного песка или опустить кусочек пемзы. Закрыть пробирку пробкой с газоотводной трубкой, укрепить ее в зажиме штатива и нагреть в пламени спиртовки.
Напишите уравнение реакции получения этилена и подпишите названия веществ:
____________________________________________________________________
Вывод: ____________________________________________________________________________________________________________________________________ Опыт №2. Горение этилена
К концу газоотводной трубки поднесите горящую спичку.
Запишите наблюдения: __________________________________________________ ________________________________________________________________________ Напишите уравнение реакции: ______________________________________________
Вывод: __________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №3. Взаимодействие этилен с раствором перманганата калия.
Опустите конец газоотводной трубки до дна в пробирку с раствором перманганата калия и пропустите через него выделяющийся газ.
Запишите наблюдения: ________________________________________________________________________________________________________________________________________________ Напишите уравнение реакции и подпишите названия веществ: ______________________________________________________________________
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________ Ответьте на вопрос. Какая еще реакция является качественной на непредельные углеводороды? Напишите ее. Подпишите изменение цвета веществ в ходе реакции.
________________________________________________________________________________________________________________________________________________
|
|
|
Контрольные вопросы
1. Какие углеводороды относятся к непредельным?
2. Почему для непредельных углеводородов характерны реакции присоединения?
3. Какова роль серной кислоты в реакции получения этилена?
4. Почему происходит обесцвечивание раствора перманганата калия при пропускании через него этилена?
5. Как при помощи бромной воды отличить этилен от этана?
Практическое занятие №4.
|
|
|


