 |
Раздел 1. Основные термины и понятия
|
|
|
|
Атом – это наименьшая электронейтральная частица химического элемента, состоящая из положительно заряженного ядра и находящихся в его поле отрицательно заряженных электронов.
Химический элемент – это совокупность атомов, имеющих одинаковый заряд атомного ядра. Заряд ядра атома равен порядковому номеру элемента и определяет его местоположение.
Молекула – это наименьшая электронейтральная частица вещества, обладающая его химическими свойствами и способная к самостоятельному существованию. Молекулы могут содержать от одного (инертные газы) до многих тысяч атомов (органические молекулы).
Ион – это заряженная частица, представляющая собой атом или группу химически связанных друг с другом атомов с избытком (анионы: SO42-, Cl-, ClO4-) или недостатком (катионы: Na+, Ca2+, NH4+) электронов.
Свободные радикалы – это частицы, содержащие ненасыщенные связи (неспаренные электроны) – (-CH3, -NH2, -H)
Химическая формула – это символическая запись, характеризующая качественный и количественный состав химического соединения и отражающая количественные соотношения между атомами разных элементов, образующих данную частицу. Химическая формула достоверно отражает количественный состав веществ, у которых преобладает ковалентная связь (Cl2, H2, H2O). Для веществ с большой долей ионной связи и веществ металлоидного типа количественные соотношения между атомами в формуле имеют усредненный характер и не отражают реального состава.
Атомная единица массы (а. е. м. ) – определяется как 1/12 часть массы атома углерода, в ядре которого содержится шесть протонов и шесть нейтронов: 1а. е. м. = 1, 66  10-27кг. Условно можно считать массы протона и нейтрона одинаковыми и равными (приблизительно) 1 а. е. м.
10-27кг. Условно можно считать массы протона и нейтрона одинаковыми и равными (приблизительно) 1 а. е. м.
|
|
|
Относительная атомная масса химических элементов ( Ar ) – это отношение массы атома данного элемента к 1/12 массы атома изотопа углерода 12С. Относительная атомная масса является величиной безразмерной.
Моль (n) – это единица количества вещества. 1 моль содержит столько же структурных единиц (атомов, ионов, молекул), сколько содержится атомов в 12 граммах изотопа углерода 12С. Число атомов в 12 граммах углерода составляет NА =6, 022· 1023моль-1. Число NА является одной из фундаментальных констант и называется постоянная Авогадро (число Авогадро).
Молярная масса (М) – это масса 1 моль вещества. Численное значение молярной массы, измеренное в г/моль, совпадает по величине с молекулярной, атомной и формульной массой данного вещества. Например,  г/моль.
г/моль.
Количество моль определяется из соотношения:
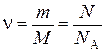 , ,
| (1. 1) |
где m, г - масса вещества; М, г/моль – молярная масса; N – число частиц (атомов или молекул).
Молекулярная масса равна сумме атомных масс всех атомов, входящих в состав молекулы  с учетом коэффициентов. Например,
с учетом коэффициентов. Например,  г/моль.
г/моль.
Валентность элемента это свойство его атомов соединяться с определенным числом других атомов. Для ковалентных соединений валентность представляет число химических связей атома, которыми этот атом связан с другими атомами, поэтому валентность не имеет знака и не может равняться нулю. Например, валентность углерода в молекуле СО ( 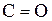 ) равна двум, а в молекуле СО2 (
) равна двум, а в молекуле СО2 (  ) равна четырем.
) равна четырем.
Коэффициенты в химическомуравненииреакции перед формулами веществ называются стехиометрическими коэффициентами . Стехиометрические коэффициенты указывают на количественное соотношение реагирующих веществ, т. е. в каких мольных отношениях взаимодействуют реагенты и образуются продукты реакции. Например, в реакции 3H2 + N2 = 2NH3 на 3 моля Н2 требуется 1 моль N2, или из 3 молей Н2 образуется 2 моля NH3.
|
|
|
|
|
|


