 |
Основные законы химии. Закон сохранения массы. Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
|
|
|
|
Основные законы химии
Среди множества законов, на которые опирается химия, можно выделить ряд основных. Это законы, сформулированные в рамках атомно-молекулярного учения. К ним относят закон сохранения массы, законы постоянства состава, кратных и объемных соотношений, закон Авогадро. Эти законы называют стехиометрическими, поскольку именно они положены в основу всех количественных расчетов масс и объемов веществ, принимающих участие в химических превращениях.
Закон сохранения массы. Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Сохранение массы вещества в химических реакциях объясняется тем, что при химических превращениях ядра атомов не разрушаются и не образуются. Учитывая, что практически вся масса атома сосредоточена в ядре, массы веществ до и после реакции должны быть одними и теми же.
Закон постоянства состава. Химические соединения с молекулярной структурой имеют постоянный качественный и количественный состав независимо от способа их получения. Данный закон строго применим только для веществ молекулярного типа.
Закон Авогадро. В равных объемах любых газов, находящихся при одинаковых температуре и давлении, содержится одинаковое число молекул.
Из закона Авогадро вытекают три следствия:
1) при одинаковых физических условиях один моль любого газа занимает один и тот же объем;
2) при нормальных условиях один моль идеального газа занимает объем 22, 4 л и этот объем называется молярным объемом (VM).
Нормальные условия ( н. у. ): Т = 273 К или 00С и Р = 101325 Па или 1атм или 760 мм. рт. ст. Количество моль в некотором объеме (V) газа при н. у. определяется из соотношения:
|
|
|
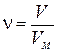 . .
| (1. 2) |
В расчётах, связанных с газами, при переходе от данных условий к нормальным или наоборот пользуются формулой объединённого газового закона Бойля–Мариотта и Гей–Люссака :
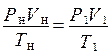 , ,
| (1. 3) |
где Р – давление; V – объём; Т – температура, а индекс «н» указывает на нормальные условия.
При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением (Pi).
Парциальное давление газа – это давление, которое оказывал бы данный газ, если бы занимал весь объем, занимаемый газовой смесью. Общее давление газовой смеси равно сумме парциальных давлений отдельных газов:
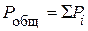 . .
| (1. 4) |
Парциальные давления газов в смеси пропорциональны их объемному содержанию. Например, газовая смесь состоит на 20% из кислорода и на 80% из азота. Давление газовой смеси составляет 1атм. В этом случае парциальное давление кислорода 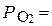 0, 2 атм., а парциальное давление азота –
0, 2 атм., а парциальное давление азота – 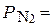 0, 8 атм.
0, 8 атм.
Объединенное уравнение, описывающее состояние идеального газа, называется уравнением состояния идеального газа (или уравнением Клапейрона – Менделеева):
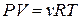 или или 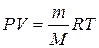 , ,
| (1. 5) |
где Р, Па – давление, при котором находится данное количество газа; V, м3 – объем, занимаемый газом; n, моль – число молей газа; Т, К ˗ абсолютная температура; R=8, 314 Дж/моль·К – универсальная газовая постоянная (R – это работа расширения 1 моля идеального газа при нагревании его на 1 градус).
2 раздел ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
В любом химическом процессе происходят энергетические изменения: выделение или поглощение теплоты, света, выполнение электрической или механической работы. Энергетические изменения связаны с разрушением химических и иных связей в исходных веществах и образованием новых связей у продуктов. Раздел химии, изучающий превращения энергии в химических реакциях, называется химической термодинамикой.
|
|
|
|
|
|


