 |
Второй закон термодинамики. Направление химических реакций
|
|
|
|
Второй закон термодинамики. Направление химических реакций
Существует несколько формулировок второго закона термодинамики: Постулат Клаузиуса, Формулировка Кельвина-Планкаи др. В отношении химических реакций их суть может быть обощена: в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т. е. Δ S > 0. Другими словами, в изолированных системах возможны только такие самопроизвольные процессы, которые приводят к возрастанию энтропии. Эти процессы будут идти до тех пор, пока энтропия системы не достигнет своего максимума, после чего наступит состояние равновесия.
В реальном мире редко приходится иметь дело с изолированными системами. Обычно в химических реакциях происходит обмен энергией с окружающей средой. Если в такой системе происходит самопроизвольный процесс, он может сопровождаться как увеличением, так и уменьшением энтропии.
Большинство химических процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга. Таким образом, существуют две тенденции для самопроизвольного процесса.
С одной стороны, система стремится к понижению потенциальной энергии и перейти в более устойчивое состояние. Эту тенденцию характеризует изменение энтальпии ̶ энтальпийный фактор. Количественно эта тенденция выражается тепловым эффектом процесса, т. е. значением Δ H0х. р. Согласно принципу самопроизвольности реакций (принцип Бертло-Томсона): химические процессы идут самопроизвольно только при выделении теплоты. Однако критерий экзотермичности процесса не является универсальным и однозначным. Самопроизвольными могут быть и эндотермические реакции. Например, реакция:
|
|
|
CH4(г) +CO2(г) =2CO(г) +2H2(г), Δ H0х. р. =256кДж
при Т=1300 К протекает самопроизвольно слева направо. Это означает, что принцип Бертло-Томсона справедлив для реакций, идущих при низких температурах.
Вторая тенденция любого процесса – стремление системы к возрастанию энтропии называется энтропийным фактором . Этот фактор тем больше, чем выше температура. Количественно энтропийный фактор оценивается произведением ТΔ S.
Таким образом, в реальных системах для определения возможности процесса следует учитывать как изменение энтропии, так и изменение энтальпии процесса. Функция, которая учитывает оба эти фактора в обратимом термодинамическом процессе при T, P = const, называется свободной энергией Гиббса (G):
| DG =DH - TDS. | (2. 12) |
Знак минус перед вторым слагаемым означает, что DS оказывает наDG влияние, обратное влиянию DH. Уравнение (3. 12) называется уравнением Гиббса.
Уравнение (2. 12), записанное в виде DH =DG + TDS, показывает, что DG соответствует той части теплоты, которую можно превратить в работу (свободная энергия), а TDS – та часть теплоты, которая в необратимых процессах бесполезно рассеивается в окружающую среду (связанная энергия). Это еще одно определение энтропии.
Таким образом, по физическому смыслу свободная энергия Гиббса – это та энергия, которая высвобождается в ходе реакции и может быть затрачена на максимально полезную работу, т. е. убыль свободной энергии равна максимально полезной работе:
| -DG = Аmax. | (2. 13) |
Термодинамический анализ соотношения (3. 13) показывает, что Δ G < 0 есть условие возможности самопроизвольного протекания реакции в прямом направлении. При Δ G > 0 протекание реакции в прямом направлении невозможно. Если же Δ G=0, наступает термодинамическое равновесие. Следовательно, свободная энергия Гиббса является критерием протекания химического процесса.
|
|
|
Пренебрегая зависимостью Δ Hх. р и DSх. р от температуры, уравнение (3. 12) можно записать в виде:
| DG х. р =Δ H0х. р - ТDS0х. р. . | (2. 14) |
О возможном направлении химического процесса можно судить по знакам изменения функций Δ Н 0х. ри Δ S 0х. р(табл. 2. 1).
Таблица 2. 1.
Влияние знака функций на направление протекания реакции
|
Знак изменения функции |
Направление самопроизвольного протекания реакции | ||
| Δ Н0 х. р | Δ S0 х. р | Δ G х. р | |
| - | + | - | Необратимая реакция. При любых температурах протекает в прямом направлении. |
| + | - | + | Необратимая реакция. При любых температурах протекает в обратном направлении. |
| - | - | ± | Обратимая реакция. В прямом направлении реакция возможна при низких температурах. |
| + | + | ± | Обратимая реакция. В прямом направлении реакция возможна при высоких температурах. |
На основании уравнения (2. 14) и данных табл. 2. 1 можно сделать вывод, что для эндотермических процессов, идущих с увеличением объема, повышение температуры способствует протеканию процесса в прямом направлении, а для экзотермических процессов, идущих с уменьшением объема, повышение температуры препятствует протеканию процесса.
Важной характеристикой химических веществ является стандартная энергия Гиббса образования веществ DG0298обр. Стандартная энергия образования Гиббса относится к 1 молю вещества (кДж/моль) и измеряется при температуре 298 К и Р=101325 Па. Условно считается, что энергия Гиббса образования простых газов или твердых веществ в одной из устойчивых кристаллических форм в стандартных условиях равна нулю. Стандартные энергии образования Гиббса для большинства веществ определены и сведены в таблицы.
Значения стандартных термодинамических функций образования веществ несут определенную информацию об этих соединениях. В ряду однотипных соединений с уменьшением DG0298, возрастает их устойчивость и сродство элементов в химическом соединении. Например, DG0298 образования хлоридов металлов по реакциям составляет:
|
|
|
Na(к) + ½ Cl2(г) = NaCl(к), DG0298(NaCl(к))= -384 кДж/моль,
Mg(к) + Cl2(г) = MgCl2(к), DG0298(MgCl2 (к))= -591, 6 кДж/моль,
Al(к) + 3/2 Cl2(г) = AlCl3(к), DG0298(AlCl3 (к))= -629 кДж/моль.
Таким образом, хлорид алюминия более устойчив к разложению, чем хлорид магния и хлорид натрия, и соответственно хлор проявляет большее сродство к алюминию.
В стандартных условиях, используя DG0298 образования отдельных веществ по второму следствию из закона Гесса, можно рассчитать изменение энергии Гиббса в конкретной реакции:
| DG0х. р=∑ iDG0298обр. (продуктов) - ∑ jDG0298обр. (исходных веществ). | (2. 15) |
Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Для состояния термодинамического равновесия DG=0, следовательно, Δ H0х. р=ТDS0х. р. Из этого равенства может быть определена температура термодинамического равновесия:
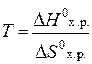 . .
| (2. 16) |
|
|
|


