 |
Энтропия. Самопроизвольные и несамопроизвольные процессы
|
|
|
|
Энтропия. Самопроизвольные и несамопроизвольные процессы
При любой температуре, отличной от абсолютного нуля, все частицы находятся в состоянии теплового движения, которое сопровождается тенденцией к максимально хаотичному распределению в пространстве. Таким образом, система стремится перейти из более упорядоченного состояния в менее упорядоченное. Например, если сосуд с газом соединить с сосудом большего объема, то газ самопроизвольно будет распределяться по обоим сосудам, т. е. система из состояния с меньшим беспорядком переходит в состояние с большим беспорядком. Количественной мерой беспорядка является энтропия S.
Любую термодинамическую систему можно описать с точки зрения ее макро- и микросостояния. Макросостояние некоторого объема идеального газа может быть описано при помощи Р, V, T. Описание микросостояния потребует описания состояния каждой частицы вещества (молекул, атомов и т. д. ). Каждому макросостоянию соответствует бесчисленное число микросостояний. Это число микросостояний называют термодинамической вероятностью состояния вещества (W). Взаимосвязь термодинамической вероятности и энтропии установлена Больцманом:
| S = k lnW, | (2. 10) |
где k –константа Больцмана равна k=R/NA=1, 38. 10-23 Дж/К.
Так как логарифм является величиной безразмерной, то размерность энтропии, отнесенная к одному молю вещества, Дж/моль·К.
Энтропия зависит от температуры и, как следствие, от агрегатного состояния вещества: при переходе от твердого состояния вещества к газообразному энтропия увеличивается. Наименьшей энтропией обладают твердые тела при низкой температуре. На рис. 3. 1 приведена зависимость изменения энтропии от температуры.
|
|
|
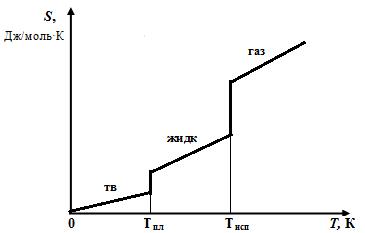
Рис. 2. 1. Изменение энтропии в зависимости от температуры
при наличии фазовых переходов твердое тело – жидкость - газ
Третий закон термодинамики (постулат Планка) определяет, что Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле температур равна нулю.
Если принять постулат Планка за действительность, то окажется, что при равновесном переходе от кристаллического состояния при абсолютном нуле в стандартное состояние получаем не относительное увеличение энтропии, а ее абсолютное значение в стандартном состоянии (S0298). Таким образом, в термодинамических таблицах приводятся значения стандартной энтропии, а не ее изменения.
Стандартное значение энтропии S0298 позволяет установить некоторые закономерности в изменении энтропии веществ:
1) усложнение молекулы приводит к возрастанию энтропии.
Например,
| Оксиды азота | S0298, Дж/моль·К |
| NО | |
| NО2 | |
| N2О4 |
2) увеличение плотности твердых веществ уменьшается их энтропия. Например, в ряду: Li(тв) Be(тв) B(тв) C (алмаз)
d, г/см3 при 20°С 0, 534 1, 848 2, 340 3, 515
S°298, Дж/моль·К 28, 07 9, 55 5, 87 2, 38
3) различие в структуре твердых веществ, находящихся в аморфном или в кристаллическом состоянии. Энтропия аморфного состояния выше, чем кристаллического.
Например, S0298(Al(OH)3)аморф. состояние = 83 Дж/моль·К,
S0298(Al(OH)3)кристаллическое состояние = 70 Дж/моль·К.
Поскольку энтропия есть функция состояния, то ее изменение в ходе химической реакции, можно рассчитать аналогично изменению энтальпии (3. 9). Изменение энтропии в химической реакции может быть рассчитано при любых температурах как разность между суммой стандартных энтропий образования продуктов реакции и суммой стандартных энтропий образования исходных веществ с учетом коэффициентов:
|
|
|
| DS0х. р=∑ S0298(продуктов) - ∑ S0298(исходных веществ) | (2. 11) |
Это возможно потому, что изменение энтропии в химической реакции так же, как и изменение энтальпии, очень слабо зависит от температуры.
Наибольшей энтропией обладают газы, поэтому в ходе химической реакции приближенно можно считать, что изменение энтропии происходит за счет изменения количества молей газа.
Все происходящие процессы можно разделить на две группы: самопроизвольные и несамопроизвольные.
Процессы, которые совершаются в системе без затраты энергии извне, называются самопроизвольными. Примерами таких процессов могут служить: переход теплоты от горячего тела к холодному, растворение соли в воде, смешение двух газов, окислительно-восстановительные реакции в химических источниках тока и др. Процессы, требующие для своего протекания затрат энергии извне, называются несамопроизвольными. Например, несамопроизвольными процессами являются: переход теплоты от холодного тела к горячему; выделение продуктов реакции при электролизе за счет затраты электрической энергии и др.
В результате самопроизвольного процесса система переходит в такое состояние, когда ее свойства больше изменяться не будут, т. е. в системе устанавливается равновесие. Из равновесного состояния система без вмешательства извне выйти не может. Таким образом, равновесным называется такое состояние системы, при котором термодинамические параметры во всех ее точках постоянны и не изменяются самопроизвольно, а энергия системы минимальна.
При устойчивом равновесии любое состояние, смежное с ним, менее устойчиво и переход к нему требует затрат работы извне. Критерии самопроизвольности процессов устанавливаются в рамках второго закона термодинамики.
|
|
|


