 |
Типичные окислители и восстановители
|
|
|
|
Типичные окислители и восстановители
Окислительно-восстановительная способность частиц зависит от энергии, с которой они притягивают к себе электроны. Энергия притяжения электронов зависит от многих составляющих. У нейтральных атомов – это величина положительного заряда атомного ядра и радиус атома, которые определяют электроотрицательность элемента. Чем больше заряд ядра и меньше радиус атома, тем энергия притяжения больше и, следовательно, выше электроотрицательность и окислительная способность атома.
Наиболее сильными окислительными свойствами обладают:
а) простые вещества, образуемые атомами р-элементов VI –VII групп 2 и 3 периодов с высокой электроотрицательностью (F2, O2, Cl2);
б) кислородсодержащие молекулы и ионы, содержащие элементы в высших степенях окисления ( 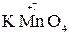 ,
, 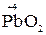
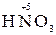 ,
, 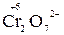 );
);
в) катионы металлов и водорода в высших степенях окисления (например, 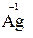 ,
, 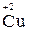 ,
, 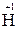 ). Такие частицы не могут повышать свои степени окисления и, следовательно, могут быть только окислителями;
). Такие частицы не могут повышать свои степени окисления и, следовательно, могут быть только окислителями;
г) перекисные соединения (например, 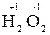 ,
, 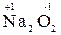 )
)
В качестве типичных восстановителей могут выступать:
а) простые вещества, с низкой электроотрицательностью (к ним относятся активные металлы, например, Na, K, Mg);
б) простые элементарные анионы (S2-, Cl-);
в) катионы металлов, атомы которых находятся в низшей степени окисления (Fe2+, Mn2+);
г) сложные вещества, в состав которых входят атомы в низких степенях окисления ( 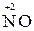 ,
, 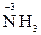 )
)
Если в состав соединения входят атомы с промежуточными степенями окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Это зависит от «партнера» по реакции.
Составление уравнений окислительно-восстановительных реакций
|
|
|
Для составления полного уравнения окислительно-восстано-вительной реакции необходимо знать свойства реагирующих веществ и на их основе определить продукты реакции. После этого надо подобрать стехиометрические коэффициенты реакции. Определение свойств веществ не входит в задачу данного пособия, поэтому будем считать, что молекулярная схема реакции известна.
Для подбора стехиометрических коэффициентов существует несколько методов, из которых наибольшее распространение получили следующие два. Метод электронного баланса и метод ионно-электронных уравнений (метод полуреакций).
Метод электронного баланса
Метод электронного баланса является наиболее универсальным методом, и применим для любых окислительно-восстановительных процессов, протекающих в любых системах (растворы, расплавы, газы). В основе метода лежит принцип сравнения степеней окисления атомов в исходных веществах и в продуктах реакции с последующим составлением схемы электронного баланса с учетом количества отданных восстановителем и принятых окислителем электронов. .
Рассмотрим этот метод на примере реакции:
KMnO4 + KNO2 +H2SO4 ®MnSO4 + KNO3 + K2SO4 + H2O
1. Определяем элементы, атомы которых изменяют степени окисления:
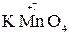 +
+ 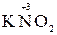 + H2SO4 ®
+ H2SO4 ® 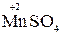 +
+ 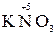 + K2SO4 + H2O
+ K2SO4 + H2O
2. Находим окислитель и восстановитель в данной ОВР, составляем схему перехода электронов от восстановителя к окислителю:


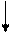 ˗ 2е
˗ 2е 


 + 5е
+ 5е 
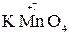 +
+ 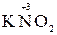 + H2SO4 ®
+ H2SO4 ® 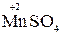 +
+ 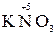 + K2SO4 + H2O
+ K2SO4 + H2O
3. Записываем уравнения реакций окисления и восстановления и составляем электронный баланс между количеством отданных и принятых электронов. После умножения уравнения складываются, как обычные алгебраические, а электроны сокращаются:
|
|
|
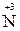 - 2е
- 2е  =
= 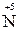 ∙ 5 окисление
∙ 5 окисление

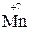 + 5е
+ 5е  =
= 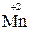 ∙ 2 восстановление
∙ 2 восстановление
5 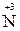 + 2
+ 2 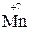 = 5
= 5 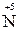 + 2
+ 2 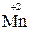
4. Коэффициенты «5» и «2» являются основными, их переносим в молекулярное уравнение:
2KMnO4 + 5 KNO2 +H2SO4 ®2MnSO4 + 5 KNO3 + K2SO4 + H2O
5. Далее методом подбора уравниваем атомы остальных элементов. В левой части уравнения имеется 1 моль атомов серы, а в правой 2 + 1 = =3моля, следовательно, перед H2SO4 ставим коэффициент «3». Затем уравниваем число атомов водорода: слева 6 моль атомов, а справа два, следовательно, перед водой должен быть коэффициент «3»:
2KMnO4 + 5 KNO2 +3H2SO4 ®2MnSO4 + 5 KNO3 + K2SO4 + 3 H2O
Проверка количества остальных атомов показывает, что все коэффициенты подобраны.
Основным недостатком метода электронного баланса является то, что в нем используется понятие степени окисления – гипотетический ион, а не реально существующий. Этот недостаток исправлен в методе ионно- электронных уравнений.
|
|
|


