 |
Схема гальванического элемента из редокс-электродов
|
|
|
|
Гальванический элемент состоит из двух полуэлементов. Первый полуэлемент представляет раствор, содержащий ионы Sn2+ и Sn4+. В раствор, в качестве электрода, опущена платиновая пластина, материал которой не принимает непосредственного участия в формировании межфазного скачка потенциала. Потенциалопределяющими ионами являются ионы олова (Sn2+ и Sn4+). Второй полуэлемент устроен аналогичным образом, но электролитом является раствор, содержащий ионы Fe2+ и Fe3+. Каждый полуэлемент является, по сути, редокс-электродом и характеризуется своим определенным потенциалом. Электролиты соединены солевым мостиком. При замыкании электродов свободные электроны по цепи начнут перемещаться, от электрода с более отрицательным потенциалом (в данном случае это полуэлемент с ионами олова) к электроду с более положительным потенциалом (полуэлемент с ионами железа). В результате в первом полуэлементе на межфазной границе начнет протекать реакция окисления:
А ( - ) Sn2+ - 2  = Sn4+,
= Sn4+,
а во втором полуэлементе – реакция восстановления ионов железа:
К ( + ) Fe3+ +  = Fe2+.
= Fe2+.
Таким образом, в гальваническом элементе начнет протекать представленная ранее реакция:
SnCl2 + FeCl3 = SnCl4 + FeCl2,
но окислитель и восстановитель непосредственно друг с другом не контактируют, т. е. процессы окисления и восстановления пространственно разделены. Обмен электронами между ними происходит через внешнюю цепь, а внутренняя энергия ОВР преобразовывается в энергию постоянного тока.
ГЭ можно создать и на основе двух одинаковых электродов, но отличающихся концентрацией потенциалопределяющих частиц, а следовательно, и потенциалами. Такие ГЭ называются концентрационными гальваническими элементами.
|
|
|
В качестве примера концентрационных ГЭ можно привести следующие системы (в скобках указаны концентрации растворов):
1) ГЭ из цинковых электродов Zn|Zn SO4 (0, 01М)|| Zn SO4 (1М)| Zn.
В правом полуэлементе концентрация ионов [Zn2+]=1моль/л, потенциал соответствует стандартному (Е0Zn2+/Zn = -0, 763В). В левом полуэлементе, согласно уравнению Нернста, потенциал равен:
ЕZn2+/Zn= Е0Zn2+/Zn + 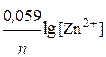 =-
=- 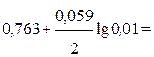
= -0, 763 - 0, 059 = -0, 822 В.
Таким образом, цинковый электрод, в левом полуэлементе имеющий меньший потенциал, будет являться анодом, а в правом полуэлементе (с наибольшим потенциалом) – катодом. Реакции, протекающие на электродах:
А (-) Zn0 - 2е  = Zn2+
= Zn2+  К (+) Zn2+ + 2е
К (+) Zn2+ + 2е  = Zn0
= Zn0
Zn0 + Zn2+ = Zn2+ + Zn0 – токообразующая реакция.
ЭДС = Екатода – Eанода = (-0, 763) – (-0, 82) = +0, 057 В.
2) ГЭ из водородных электродов Pt, H2|H+, рН=4||+, рН=2|H2, Pt.
В левом полуэлементе ЕН+/1/2Н2= -0, 059рН= -0, 059∙ 4= -0, 236В.
В правом полуэлементе ЕН+/1/2Н2= -0, 059рН= -0, 059∙ 2= -0, 118В.
Следовательно, левый элемент выступает в роли анода:
А (-) H2 - 2е  = 2H+ а правый в роли катода, на котором протекает реакции:
= 2H+ а правый в роли катода, на котором протекает реакции:  К (+) 2H+ + 2е = H2
К (+) 2H+ + 2е = H2

H2+ 2H+ = 2H+ + H2 - токообразующая реакция.
ЭДС = Екатода – Eанода = (-0, 118) – (-0, 236) = +0, 118 В.
В случае концентрационных ГЭ различие между электродными потенциалами незначительно, поэтому ЭДС в них имеет невысокие значения.
Гальванические элементы получили широкое применение в качестве источников энергии, в первую очередь из-за их портативности и мобильности. Промышленность выпускает огромное количество разнотипных ГЭ. Они отличаются конструкцией, составом электролитов и другими параметрами. Вместе с этим все химические источники тока, работающие по принципу ГЭ, не свободны от недостатков: стоимость веществ, необходимых для их работы достаточно высока, а отношение количества энергии, которую может дать элемент, к его массе мало.
|
|
|


