 |
Гальванические элементы. Рис. 6.5. Медно-цинковый гальванический элемент
|
|
|
|
Гальванические элементы
Простейший гальванический элемент (ГЭ) состоит из двух полуэлементов: пластин, изготовленных из различных металлов и погруженных в раствор электролита, содержащий собственные ионы. Металлические пластины соединены между собой проводником первого рода (проводом), а растворы – электролитическим ключом (солевым мостиком). Условно схема такого ГЭ записывается в виде Ме1|Ме1n+||Me2m+|Me2.
В качестве примера рассмотрим работу стандартного медно-цинкового гальванического элемента (элемент Даниэля – Якоби) (рис. 6. 5), и в основе которого лежит самопроизвольная ОВ-реакция между цинком и сульфатом меди:
Zn + CuSO4 = ZnSO4 + Cu
Устройство состоит из цинковой пластины, опущенной в 1М раствор ZnSO4, и медной пластины, погруженной в 1М раствор CuSO4. Металлические пластины соединены между собой проводником первого рода, а растворы – электролитическим ключом. В первом полуэлементе формируется скачок потенциала за счет равновесия между атомами цинка в металле и ионами цинка в растворе:
Zn0 - 2  ⇄ Zn2+ Е0Zn2+/Zn = -0, 763В Во втором полуэлементе потенциал возникает за счет равновесия меди в металле и ионами меди Cu2+ + 2
⇄ Zn2+ Е0Zn2+/Zn = -0, 763В Во втором полуэлементе потенциал возникает за счет равновесия меди в металле и ионами меди Cu2+ + 2  ⇄ Cu0 Е0Cu2+/Cu = +0, 337В.
⇄ Cu0 Е0Cu2+/Cu = +0, 337В.
При замыкании внешней электрической цепи, за счет разных потенциалах на электродах, электроны от цинкового электрода переходят к медному электроду. Это приводит к нарушению исходных равновесий: в результате чего на цинковом электроде протекают процессы окисления, а на медном электроде процессы восстановления, обеспечивая поддержание их потенциалов.
В электрохимии принято электрод, на котором протекают реакции окисления, называть анодом, а электрод, на котором идут реакции восстановления, – катодом .
|
|
|
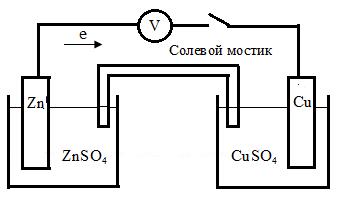
Рис. 6. 5. Медно-цинковый гальванический элемент
Таким образом, цинк, имеющий меньший электродный потенциал, является анодом, а медь (с наибольшим потенциалом) – катодом. При окислении цинка с его поверхности ионы Zn2+, уходят в раствор. На катоде ионы Cu2+ из раствора восстанавливаются, при этом в растворе остаются неуравновешенными ионы SO42-. Образовавшиеся при окислении цинка положительные ионы Zn2+ притягивают через солевой мостик отрицательные ионы SO42-. В результате в растворе возникает электрический ток за счет движения отрицательных анионов, а в проводнике первого рода – за счет движения электронов.
Условно схема данного ГЭ записывается в виде:
А ( - ) Zn|Zn2+||Cu2+|Cu ( + ) К.
Реакции, протекающие на электродах при работе данного ГЭ:
А (-) Zn0 - 2  = Zn2+ К (+) Cu2+ + 2
= Zn2+ К (+) Cu2+ + 2  = Cu0
= Cu0
 |
Суммарная реакция Zn0 + Cu2+ = Cu0 + Zn2+ или
Zn + CuSO4 = ZnSO4 + Cu.
Последние две реакции, записанные в ионно-молекулярном и молекулярном виде, называются токообразующми реакциями.
Стандартная электродвижущая сила (ЭДС) или ДЕ0 определяется как разность потенциала окислителя и восстановителя:
∆ Е= Е0катода – E0анода = +0, 337 – (-0, 763) = +1, 10 В.
Для повышения ЭДС можно изменить концентрацию потенциал-определяющих ионов. В медно-цинковом ГЭ, увеличивая концентрацию раствора CuSO4 и снижая концентрацию раствора ZnSO4, то есть, изменяя стандартные потенциалы цинкового и медного электродов, можно повысить ЭДС на десятки милливольт.
В принципе, ГЭ можно составить на основе любой самопроизвольной ОВР. В качестве примера рассмотрим самопроизвольную ОВ реакцию в водном растворе между хлоридом 2- валентного олова и хлоридом 3- валентного железа:
SnCl2 + FeCl3 = SnCl4 + FeCl2.
В данной реакции происходит окисление ионов Sn2+ ионами железа Fe3+:  Sn2+ - 2
Sn2+ - 2  = Sn4+ Е0 Sn4+/Sn2+ = +0, 151В
= Sn4+ Е0 Sn4+/Sn2+ = +0, 151В
|
|
|
Fe3+ +  = Fe2+ · 2 Е0 Fe3+/Fe2+ = +0, 771В
= Fe2+ · 2 Е0 Fe3+/Fe2+ = +0, 771В
 Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
Для получения электрического тока за счет этой реакции необходимо создать ГЭ, представленный на рис. 6. 6.
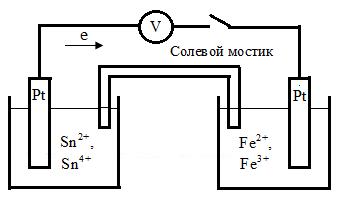
|
|
|


