 |
Закони світлопоглинання
|
|
|
|
Для кількісних визначень краще використовувати монохроматизоване світло, а саме світло з визначеною довжиною хвилі. Якщо на розчин, який міститься в кюветі, спрямувати монохроматизоване світло певної інтенсивності І0, то частина світла пройде (It), частина віддзеркалиться (Iв), частина поглинається.

Тобто можна записати, що
І0=Іп+Іt
Івіддз – невелика і постійна, тому
І0=Івіддз+Іп+Іt
In=f(c)
Про долю поглиненого світла судять за двома величинами: оптичній густині (А) та світлопропускання (Т).
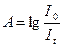 , а
, а  , або
, або 
Світлопропускання змінюється від 0 до 100%, а оптична густина від ∞ до 0.
Згідно закону Бугера-Ламберта: шари речовини однієї товщини при інших рівних умовах поглинають одну й ту саму частину падаючого світлового потоку. В математичній формі це можна записати таким чином:
It = I0 × 10-kl,
де l – товщина шару,
k – коефіцієнт пропорційності.
Закон Бера відображає зв¢ язок між інтенсивністю поглинання і концентрацією речовини, що має вигляд:
It=I0∙ 10-k¢ ∙ C.
Об’єднаний закон Бугера –Ламберта – Бера враховує і товщину шару і концентрацію:
It=I0∙ 10-k∙ k¢ ∙ C∙ l або It=I0∙ 10-ε ∙ C∙ l.
Зробивши перетворення отримуємо:
lg  = A = ε сl,
= A = ε сl,
де Іt – інтенсивність ослабленого поглинанням світлового потоку, що пройшов через розчин, який аналізують; Іо – інтенсивність падаючого світлового потоку; ε – молярний коефіцієнт поглинання; 1 – товщина світлопоглинаючого шару (см); с – концентрація розчину (моль/л); А – оптична густина розчину.
Фізичний зміст “ε ” стає зрозумілим, якщо прийняти l = 1 см, с = 1 моль/л, тоді А=ε. Отже, молярний коефіцієнт поглинання дорівнює оптичній густині одномолярного розчину при товщині шару 1 см та характеризує інтенсивність забарвлення та чутливість визначення. Відповідно до цього закону - оптична густина прямо пропорційна кількості речовини і товщині поглинаючого шару.
|
|
|
Принцип (або правило) адитивності оптичної густини проявляється, якщо в розчині присутні декілька світлопоглинаючих компонентів, що не вступають один з одним у хімічну реакцію, то за умови дотримання закону Бугера-Ламберта-Бера, оптична густина такого розчину буде дорівнювати сумі парціальних оптичних густин усіх світлопоглинаючих компонентів.

На використанні принципу адитивності базуються всі кількісні методи спектрофотометричного аналізу багатокомпонентних систем.
Закон Бугера –Ламберта – Бера має низку обмежень, які треба враховувати, а саме:
– закон справедливий лише для монохроматичного випромінювання;
– величина коефіцієнту ε залежить від показника заломлення середовища, який практично не залежить від концентрації тільки у випадку малих її значень. У разі високих концентрацій розчиненої речовини зміна показника заломлення спричиняє відхилення від закону;
– якщо в процесі зміни концентрацій відбуваються фізико-хімічні зміни частинок, що поглинають світло (димерізація, полімеризація, міцелоутворення, зміна складу тощо), то це викликає відхилення від закону;
– температура під час вимірів повинна залишатись сталою;
– пучок випромінювання повинен бути паралельним.
Для розрахунку концентрації речовини застосовують наступні способи:
1. Графічний – базується на побудові калібрувального графіку в координатах А(оптична густина) - С (концентрація). Для цього вимірюють оптичну густину еталонних розчинів при обраному світлофільтрі, і оптичну густину досліджуваного розчину Ах, потім з допомогою калібрувального графіку визначають концентрацію речовини Сх. Підпорядкування закону Бера не є строго необхідною умовою для цього методу. Якщо для досліджуваних у визначених умовах речовин, установлені відповідна залежність А від С, що представляє криву, а не пряму, то вона може служити калібрувальним графіком, але для її побудови необхідно більше еталонних розчинів. Застосування графічного способу є одним з найпоширеніших.
|
|
|
2. Порівняння - ґрунтуєтьсяна порівнянні оптичної густини стандартного і досліджуваного розчинів, приготованих за однакових умов. Визначивши Aх, знаходять сх
Aст = ε сстl та Aх = ε схl.
Оскільки ε та l у даному випадку сталі величини, то
Aх / Aст = сх / сст,
Звідки

(необхідне підпорядкування закону Бугера-Ламберта-Бера).
3. Добавок – доцільно використовувати, аналізуючи розчини до складу яких входить декілька різних компонентів. Спочатку у дві мірні колби відбирають визначений об'єм розчину досліджуваної речовини. В одну з цих колб додають стандартний розчин. Після переведення компонента в забарвлену сполуку, об'єми розчинів в колбах доводять до мітки фоном і вимірюють оптичну густину цих розчинів.
Aх = ε схl,
Aх+ст = ε (сх + сст) l
З цих рівнянь:

4. диференційний -полягає у вимірюванні оптичної густини розчину, що аналізують, не по відношенню до води (розчиннику), а по відношенню до іншого забарвленого розчину відомої концентрації. Таким чином вимірюють ∆ А стандартних розчинів по відношенню до нульового (з серії)
A0 = ε с0l, Aст = ε сстl, ∆ А = Aст - A0
A0 – оптична густина нульового (з серії) розчину відомої концентрації;
Aст – оптична густина стандартного розчину відомої концентрації.
Використовуючи набір еталонних розчинів, будують калібрований графік в координатах ∆ А - С (концентрація). Виміряв ∆ А розчину, що аналізується, по графіку знаходять його концентрацію.

Калібрувальні графіки звичайної (1) і диференційної (2, 3) фотометрії
Диференційна фотометрія значно розширює область концентрацій, в якій можна реалізувати точні фотометричні виміри.
5. Молярного коефіцієнта світлопоглинання - полягає в вимірюванні оптичної густини декількох стандартних розчинів і для кожного обчислюють молярний коефіцієнт поглинання ε:
|
|
|
ε =  .
.
Знаходять середнє значення ε ср. Визначивши оптичну густину проби Aх, знаходять його концентрацію:
Сx = 
У даному випадку, необхідно знати точні значення молярного коефіцієнта поглинання в реальних умовах, тому метод використовується рідко.
6) фотометричного титрування – базується на застосування приладу, що повинен містити устаткування для титрування. В процесі титрування слідкують за зміною оптичної густини розчину. По отриманим даним будують графік в координатах А – VR (мл). Графічно знаходять точку еквівалентності і визначають об’єм титранта, що пішов на титрування, та розраховують вміст речовини X, що визначається.
Х + R ↔ ХR
m (X)/M (1/z X) = c (1/z R) VR/ 1000
Криві фотометричного титрування мають різну форму. Зміна оптичної густини А, якщо в розчині максимальне світлопоглинання дає речовина X, яка знаходиться в розчині, що титрують, при λ maxх має вигляд:

Зміна А, якщо в розчині максимальне світлопоглинання дає титрант R (надлишок R поглинає світло), який додають в розчин, при λ max:
|

6Fe2+ + Cr2O72- + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
|
|

Зміна А, якщо в розчині максимальне світло поглинання має продукт реакції XR, яка утворюється, при λ maxXR:
Наприклад: Fe3++[H2Sal]-→ [FeSal]+2H+
|


|
|
|


