 |
Список літератури. Приклади розв'язування типових задач. Задачі для самостійного розв'язування
|
|
|
|
СПИСОК ЛІТЕРАТУРИ
1. Бабко А. К. Пилипенко А. Т. Фотометрический анализ. Общие сведения и аппаратура. М.: «Химия», 1968. 388 с.
2. Бабко А. К. и др. Физико-химические методы анализа. М.: «Высшая школа», 1968. 335 с.
3. Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Часть первая. М.: «Химия», 1969. 668 с.
4. Скуг Д., Уэст Д. Основы аналитической химии. - М.: Мир, 1979. – Т. 1. 480с.; Т. 2, 438с.
5. Васильев В. П. Аналитическая химия. – М.: Высш. шк., 1989. – Кн. 1. – 320 с. – Кн. 2. – 384с.
6. Методичні вказівки до лабораторного практикуму з фізико-хімічних методів аналізу (фотометричний метод) для студентів ІІІ-ІV курсів технологічних спеціальностей / Укл.: В. І. Супрунович, Ю. І. Шевченко, Н. Г. Федорова. – Дніпропетровськ: УДХТУ, 2002. – 45 с.
7. Методичні вказівки для самостійної роботи з курсу “Аналітична хімія” (Інструментальні та фізико-хімічні методи аналізу) для студентів ІІІ курсів усіх спеціальностей напрямків “Хімічна технологія та інженерія”, “Харчова технологія та інженерія”, “Біотехнологія”, “Фармація” денних та заочних форм навчання / Укл.: В. І. Супрунович, І. Л. Плаксієнко, Н. Г. Федорова, Ю. І. Шевченко. – Дніпропетровськ: УДХТУ, 2004. – 670 с.
Приклади розв'язування типових задач
Приклад 1. 4, 97 г нафти піддали мокрому озоленню і розбавили до
500 мл у мірній колбі. Визначення вмісту кобальту виконували за таких умов:
| Об’єм розбавленої проби, мл | Об’єм компонента, мл | Оптична густина | ||
| Со(ІІІ), 3, 0 мкг/мл | Реагент | Вода | ||
| 25, 0 25, 0 | 5, 0 | 20, 0 20, 0 | 5, 0 | 0, 398 0, 510 |
Вважаючи, що розчин хелату Со(ІІ)-ліганд відповідає закону Бера, обчислити процентний вміст Со(ІІ) у вихідній пробі.
|
|
|
Розв'язування
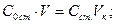
 мкг/мл;
мкг/мл;

 мкг/мл;
мкг/мл;
 мкг/мл;
мкг/мл;
 г;
г;
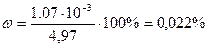
Відповідь: 0, 022 %.
Приклад 2. Коефіцієнт світлопропускання розчину, що містить 3, 75 мг Кобальту у 100, 00 мл, який виміряний при довжині хвилі випромінювання
 480 нм у кюветі завтовшки l = 1, 5 см, становить Т = 39, 6 %. Обчислити величину молярного коефіцієнта поглинання.
480 нм у кюветі завтовшки l = 1, 5 см, становить Т = 39, 6 %. Обчислити величину молярного коефіцієнта поглинання.
Розв'язування
Світлопропускання розчину Т = 0, 396, і за формулою

обчислюють оптичну густину розчину:

Для знаходження молярного коефіцієнта поглинання спочатку обчислюють молярну концентрацію розчину, а потім за законом Бугера-Ламберта-Бера, значення молярного коефіцієнта:
 моль/л;
моль/л;


Відповідь: 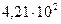

Приклад 3. Відносна оптична густина сульфосаліцилату комплексу феруму (ІІІ) Авідн., х = 0, 290, товщина кювети l = 5 см. Розчин порівняння містить 0, 1576 мг Fe в 50, 00 мл,  . Яка концентрація солі феруму (ІІІ) у розчині, мкг/мл?
. Яка концентрація солі феруму (ІІІ) у розчині, мкг/мл?
Розв'язування
Вміст феруму (ІІІ) у розчині досить високий, тому визначення проводять методом диференціальної фотометрії. Спочатку обчислюють молярну концентрацію Fe(III) у розчині порівняння:
 моль/л.
моль/л.
За відомою відносною оптичною густиною

та концентрацією розчину порівняння обчислюють молярну концентрацію досліджуваного розчину та його титр:

 моль/л
моль/л
 моль/л.
моль/л.
Розраховуємо концентрацію солі феруму (ІІІ) у мкг/мл:
 мг/мл
мг/мл  мкг/мл.
мкг/мл.
Відповідь:  мкг/мл.
мкг/мл.
Задачі для самостійного розв'язування
1. Після розчинення 0, 25 г сталі розчин розбавили до 100 мл. У три колби місткістю 50, 0 мл помістили по 25, 0 мл розчину і додали: у першу колбу- стандартний розчин, що містить 0, 5 мл титану, а також H2O2 і H3PO4; у другу – розчин H2O2 і H3PO4; у третю – розчин H3PO4 (нульовий розчин ). Розчини розбавили до мітки і фотометрували два перших розчини відносно третього. Одержали такі значення оптичної густини: Ах+ст. = 0, 650; Ах = 0, 250. Визначити процентний вміст титану в сталі.
|
|
|
2. З наважки сталі масою 0, 2542 г після відповідної обробки одержали 100, 0 мл розчину, що містить диметилгліоксимат нікелю. Оптична густина цього розчину відносно розчину порівняння, що містить 6, 0 мг нікелю в 100, 0 мл, дорівнює 0, 44. Для побудови градуювального графіка взяли три стандартні розчини зі вмістом 4, 00; 8, 00; 10, 00 мг нікелю в 100, 0 мл і одержали за тих же умов відносні оптичні щільності відповідно: - 0, 24; 0, 24; 0, 46. Обчислити масову частку (%) нікелю в сталі.
3. Використовуючи наведені в таблиці дані, розрахувати відсутні в ній значення:
| Оптична густина, А | Молярний коефіцієнт поглинання | Товщина шару, см | Концентрація |
| 0, 547 | ? | 1, 0 | 3, 64*10-5 М |
| ? | 2, 5 | 6, 51 мкг/мл (М=200) | |
| 0, 229 | 2, 96*103 | ? | 3, 86*10-5 |
| 0, 447 | 1, 0 | ? М | |
| 0, 581 | 4, 27*103 | 1, 5 | ? мкг/мл (М=254) |
4. Перевести дані вимірювання пропускання в показники оптичної густини: 1) 19, 4 %; 2) 0, 863; 3) 27, 2%, 4) 4, 51%, 5) 0, 100; 6) 79, 8%.
5. Пропускання розчину з концентрацією речовини 3, 2 мг Al у 100 мл, виміряне на лінії 480 Нм у кюветі з l = 2 см, становить 34, 6 %. Розрахувати молярний коефіцієнт поглинання цієї речовини.
6. Максимум поглинання халату ZnQ22- лежить на лінії з довжиною хвилі 480 нм. Якщо реагент присутній принаймні в п’ятикратному надлишку, оптична густина залежить тільки від концентрації Zn(II) і розчини відповідають закону Бера в широкому інтервалі концентрацій. Ні Zn2+, ні Q2- не поглинають випромінювання з довжиною хвилі 480нм. Оптична густина розчину, що містить 2, 3*10-4 М Zn2+ і 0, 6*10-3 М Q, на лінії 480 нм у кюветі довжиною 7, 0 см дорівнює 0, 690. Оптична густина розчину, що містить 2, 3*10-4 М Zn2+ і 5, 0*10-4 М Q, за тих же умов становить 0, 540. Визначити чисельне значення К реакції
Zn2+ + 2Q2- = ZnQ2-.
7. Вміст антрацену у розчині визначено методом диференціальної фотометрії за поглинанням самого антрацену при λ = 253 нм. Розчин порівняння містив
30, 0 мг/л антрацену. Оптична густина стандартного розчину з вмістом 35, 0 мг/л антрацену відносно розчину порівняння була 0, 412, а досліджуваного 0, 396. Знайти концентрацію антрацену (мг/мл) у досліджуваному розчині.
8. Наважку сталі масою m г розчинили, перенисли в колбу місткістю 50, 0 мл. Дві проби по 20, 0 мл помістили в колби місткістю 50, 0 мл. В одну із колб додали розчин, що містить 0, 0030 г V. В обидві колби долили пероксид водню і довели водою до мітки. Обчислити масову частку (%) ванадію в сталі, якщо в результаті фотометрування розчинів одержали такі значення оптичної густини:
|
|
|
| Показник | Варіант | |||
| m | 0, 5000 | 0, 6572 | 0, 7468 | 0, 9580 |
| Ах | 0, 20 | 0, 23 | 0, 25 | 0, 28 |
| Ах+ст. | 0, 48 | 0, 51 | 0, 53 | 0, 56 |
9. Наважку руди масою m г розчинили і після відповідної обробки від титрували іони Fe2+ розчином перманганату калія фотометричним методом. Побудувати криву титрування і розрахувати масову частку (%) заліза у зразку за такими результатами вимірювання:
| Варіант | Наважка зразка, г | Концентрація розчину KMnO4 | Оптична густина розчинів після додавання KMnO4, мл | |||||
| 1, 0389 1, 0200 0, 9987 | 0, 1075 н ТKMnO4 /Fe = 0, 005544 | |||||||
| 0, 010 0, 010 0, 020 | 0, 010 0, 010 0, 020 | 0, 010 0, 045 0, 075 | 0, 050 0, 110 0, 140 | 0, 100 0, 175 0, 200 | 0, 150 0, 240 0, 235 | |||
10. Молярний коефіцієнт поглинання комплексу Bi(III) з тіомочевиною  л*см-1*моль-1. Яка оптична густина
л*см-1*моль-1. Яка оптична густина  моль/л розчину, що виміряна на лінії спектра 470 нм у кюветі, завдовжки 1 см? Яке пропускання цього розчину у відсотках?
моль/л розчину, що виміряна на лінії спектра 470 нм у кюветі, завдовжки 1 см? Яке пропускання цього розчину у відсотках?
|
|
|


