 |
4.3. Концентрация растворов и способы ее выражения
|
|
|
|
Величиной, характеризующей количественный состав раствора, является концентрация.
Существуют различные способы выражения концентрации. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества ω - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:


Массовую долю растворённого вещества w обычно выражают в долях единицы или в процентах, тогда это будет процентная концентрация, С%. Например, если в100 г CaCl2 содержится 6 г CaCl2 и 94 г воды, то массовая доля растворённого вещества - CaCl2 в воде равна 0, 06 или 6%.
Пример:
Необходимо рассчитать количество сульфата натрия и воды необходимых для приготовления 300 г 5% раствора?
Решение.
m(Na2SO4) = w(Na2SO4) / 100 = (5 • 300) / 100 = 15 г
где w(Na2SO4) - массовая доля Na2SO4 в %,
m - масса раствора в г
m (H2O) = 300 г - 15 г = 285 г.
Молярная концентрация (молярность) CМ, моль/л показывает, сколько моль растворённого вещества содержится в 1 литре раствора.

где υ в-ва – количество растворенного вещества в растворе, моль; Vр-ра – объем раствора, л.

Здесь необходимо напомнить значение понятия молярная масса:
Молярная масса – это масса одного моля вещества.
Моль – это единица измерения количества вещества. 1 Моль любого вещества содержит одно и тоже количество молекул NA 6, 02214179(30)× 1023 (постоянная Авогадро).
Иначе говоря, моль — это количество вещества, масса которого, выраженная в граммах, численно равняется его молекулярной массе.
Молекулярная масса - величина справочная, указанная для каждого химического элемента в Периодической таблице. Молекулярная масса вещества складывается из сумм молекулярных масс слагающих его элементов
|
|
|

Молярная концентрация измеряется в моль/л и обозначается " M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (Молекулярная масса NaOH равна 40 ).
Пример.
Нужно рассчитать массу хромата калия K2CrO4 нужно взять для приготовления 1, 2 л 0, 1 М раствора?
Решение.
M(K2CrO4) = C(K2CrO4) • V • M(K2CrO4) = 0, 1 моль/л • 1, 2 л • 194 г/моль = 23, 3 г.
Таким образом, для приготовления 1, 2 л 0, 1 М раствора нужно взять 23, 3 гK2CrO4 и растворить в воде, а объём довести до 1, 2 литра.
Моляльная концентрация (моляльность раствора) Cm , (моль/кг) - количество молей растворённого вещества в 1000 г растворителя.

где υ в-ва – количество растворенного вещества в растворе, моль; m р-ля– масса растворителя, кг.
Нормальная концентрация (нормальность, эквивалентная концентрация), СН, (экв/л) обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.

где υ в-ва – количество растворенного вещества в растворе, экв; Vр-ра – объем раствора, л.

Грамм - эквивалентом (эквивалентной массой) вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
В общем виде эквивалентная масса вещества (Э) связана с молярной (М) следующим образом:
Э основания = М основания / число замещаемых в реакции гидроксильных групп
Э кислоты = М кислоты / число замещаемых в реакции атомов водорода
Э соли = М соли / произведение числа катионов на его заряд
Пример.
Необходимо вычислить значение грамм-эквивалента (г-экв. ) серной кислоты, гидроксида кальция и сульфата алюминия.
|
|
|
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2 • 3) = 342 / 2= 57 г

Величины нормальности обозначают буквой " Н". Например, децинормальный раствор серной кислоты обозначают " 0, 1 Н раствор H2SO4".
Пример.
Необходимо рассчитать молярность и нормальность 70% раствора H2SO4 (ρ (плотность) = 1, 615 г/мл).
Решение.
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1, 615 = 61, 92 мл
Следовательно, в 1 л раствора содержится 70 • 1000 / 61, 92 = 1130, 49 г H2SO4
Отсюда молярность данного раствора равна: 1130, 49 / М (H2SO4) =1130, 49 / 98 =11, 53 M
Нормальность этого раствора равна 1130, 49 / (98/2) =23, 06 H
Титр , Т, (г/мл) – величина, показывающая, какая масса растворенного вещества содержится в 1 мл раствора:

где m в-ва – масса растворенного вещества в растворе, г; Vр-ра – объем раствора, мл.
Мольная доля вещества в растворе представляет собой отношение числа молей этого вещества к суммарному количеству молей всех компонентов раствора:
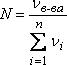
где υ в-ва – число молей компонента, для которого определяется мольная доля; n – количество компонентов раствора.
|
|
|


