 |
4.4. Водородный показатель. Кислотно-основные индикаторы
|
|
|
|
Помимо концентрации, еще одним важным показателем, характеризующим раствор, является его реакция среды.
Водоро́ дный показатель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:

В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH− ]) одинаковы и составляют 10− 7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH− ] и составляет 10− 14 моль² /л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты, которая как электролит диссоциирует по схеме:
Н2SO4 2 Н+ + SO4 2-

 концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Например при диссоциации гидроксида натрия:
концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Например при диссоциации гидроксида натрия:

 NaOH Na+ + OH-
NaOH Na+ + OH-
Когда [H+] > [OH− ] говорят, что раствор является кислым, а при [OH− ] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
|
|
|

как в любом водном растворе при 25 °C [H + ][OH − ] = 1, 0× 10 − 14, очевидно, что при этой температуре:
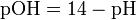
Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10− 15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = − 1.
Так как при 25 °C (стандартных условиях)[H+] · [OH− ] = 10− 14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10− 7, то pH кислых растворов pH < 7, аналогично pH щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH− ); при понижении температуры, напротив, нейтральная pH возрастает.
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Примеры перехода окраски в зависимости от кислотности среды для наиболее распространенных индикаторов приведены на рис. 4. 4. 1.
|
|
|
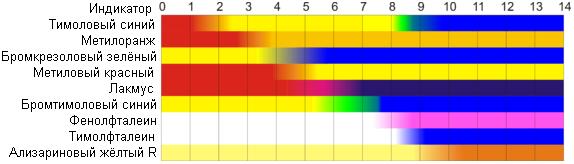
Рис. 4. 4. 1. Диапазон перехода окраски индикаторов в зависимости от pH среды.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0, 01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Ощутимое влияние на pH имеет температура. Так, например:
0. 001 моль/л HCl при 20 °C имеет pH=3, при 30 °C pH=3
0. 001 моль/л NaOH при 20 °C имеет pH=11. 73, при 30 °C pH=10. 83
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
|
|
|


