 |
Особенности работы тормозного химического синапса
|
|
|
|
Особенности работы тормозного химического синапса
В тормозном химическом синапсе молекулы медиатора, взаимодействуя с рецепторами постсинаптической мембраны, вызывают открытие К+ и (или) Cl – -хемочувствительных каналов. Вход в клетку Cl– и дополнительная утечка из клетки К+ приводят к гиперполяризации постсинаптической мембраны, которую называют тормозным постсинаптическим потенциалом (ТПСП). Возникшая гиперполяризация, во-первых, снижает возбудимость клетки. Во-вторых, ТПСП может нейтрализовать возникший в другом месте клетки ВПСП (рис. 8Б). Часто на мембране нейрона происходит суммация возбуждающих и тормозящих потенциалов. В результате такой суммации возможно как возбуждение, так и торможение нейрона (рис. 8В). 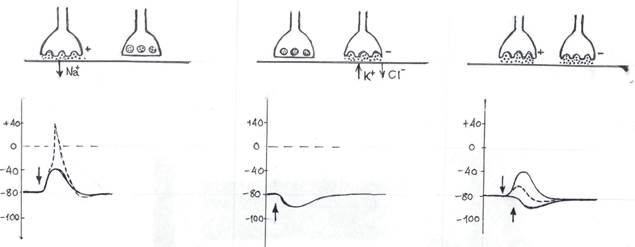
Рис. 8 Принципы работы возбуждающего (слева), тормозного синапса (в центре) и их совместное возбуждение (справа).
Свойства синапсов
Одностороннее проведение возбуждения в химическом синапсе связано с его функциональной асимметрией: молекулы медиатора выделяются только на пресинаптической мембране, а рецепторы медиатора расположены только на постсинаптической мембране.
Высокая утомляемость химического синапса объясняется истощением запасов медиатора. Утомляемость электрического синапса больше утомляемости нервного волокна.
Низкая лабильность химического синапса определяется главным образом периодом рефрактерности хемочувствительных каналов на постсинаптической мембране.
Синаптическая задержка – время от момента возникновения возбуждения в пресинаптической мембране до момента возникновения возбуждения в постсинаптической мембране. Относительно длительное время синаптической задержки в химическом синапсе (0, 2–0, 7 мс) затрачивается на вход Са++ в синаптическое окончание, экзоцитоз, диффузию медиатора.
|
|
|
Чувствительность синапса к внешним воздействиям определяется характером процессов, протекающих в синапсе при передаче возбуждения. Химические синапсы чувствительны к действию химических веществ, влияющих на синтез и секрецию медиатора, взаимодействие медиатора с рецептором.
Медиаторы и модуляторы синаптической передачи
По химической структуре медиаторы подразделяют на:
• моноамины (адреналин, норадреналин, ацетилхолин и др. );
• аминокислоты (гамма-аминомасляная кислота (ГАМК), глутамат, глицин, таурин);
• пептиды (эндорфин, нейротензин, бомбезин, энкефалин и др. );
• прочие медиаторы (NO, АТФ).
Вариабельность действия медиаторов проявляется в том, что один и тот же медиатор в разных синапсах может оказывать различное действие на эффекторную клетку. Результат действия медиатора на постсинаптическую мембрану зависит от того, какие рецепторы и ионные каналы в ней находятся. Если медиатор открывает в постсинаптической мембране Na+ -каналы, то это приводит к развитию ВПСП, если K+ - или Cl – -каналы, то развивается ТПСП. Вследствие этого термины «возбуждающий медиатор» и «тормозный медиатор» неправомерны; следует говорить лишь о возбуждающих и тормозных синапсах.
В синаптическом окончании наряду с медиатором могут синтезироваться и высвобождаться одно или несколько химических веществ. Эти соединения, действуя на постсинаптичекую мембрану, могут повышать или снижать ее возбудимость. Поскольку сами по себе они не могут вызвать возбуждение постсинаптической мембраны, их называют модуляторами синаптической передачи (нейромодуляторами). Большинство нейромодуляторов представляют собой пептиды.
ФИЗИОЛОГИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
Основным функциональным элементом поперечно-полосатых мышц является саркомер, состоящий из определенным образом расположенных толстых и тонких миофиламентов, находящихся между двумя Z- пластинками (Рис. 9). При исследовании поперечного среза саркомеров было показано, что существует строго регулярная укладка перекрывающихся толстых и тонких нитей. Каждая толстая нить окружена гексагональной решеткой из шести тонких нитей.
|
|
|
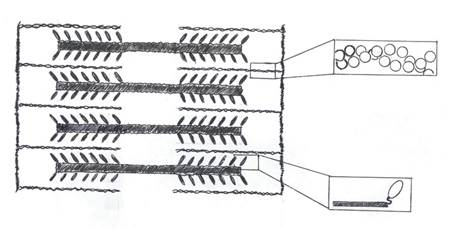
Рис. 9 Структура саркомера. В вставках показана ультраструктура нити актина и миозиновой молекулы
Толстые нити состоят из белка миозина. В свою очередь макромолекула миозина состоит из двух частей – тяжелого меромиозина (представленного двумя компонентами похожими на головки), обладающего АТФазной активностью, и легкого меромиозина, соединенного с тяжелой частью своеобразной молекулярной пружиной. Легкие цепи вплетены в толстую нить, а головки тяжелого меромиозина выступают за пределы нити и способны взаимодействовать с тонкими нитями, образуя при этом так называемые «поперечные мостики».
Тонкие нити состоят из двух ниток фибриллярного белка актина, каждая из которых составлена из отдельных молекул глобулярного актина. Актиновый филамент внешне напоминает две нитки бус, закрученные в двойную спираль, где каждая бусина – молекула белка актина. В ложбину между двумя нитками актина уложена длинная нитка регуляторного белка тропомиозина, на конце которой находится регуляторный белок тропонин (рис. 10).
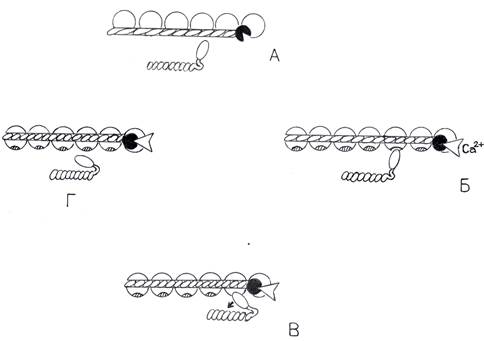
Рис. 10 Взаимодействие сократительных (актина и миозина) и регуляторных белков (тропомиозина и тропонина) в ходе цикла сокращения.
Этапы взаимодействия сократительных и регуляторных белков в ходе мышечного сокращения.
А- состояние покоя. Активационные места молекул миозина закрыты тропомиозином.
Б- взаимодействие Са с тропонином. Конформационное изменение тропонина сдвигает тропомиозин и позволяет миозину связаться с активационными местами актина.
В- сгибание шейки поперечного мостика (головки миозина) и продвижение макромолекул миозина относительно актина. Продукты гидролиза (АДФ и неорганический фосфат) освобождаются из связи с головкой миозина (мостиком).
Г- новая молекула АТФ связывается с головкой миозина, что позволяет ей отсоединиться от актина для разгибания и подготовки следующего цикла сокращения
|
|
|
Процесс преобразования электрического сигнала ПД в сокращение миофиламентов называется электро-механическим сопряжением (ЭМС). Процесс ЭМС состоит из ряда этапов (рис. 11):
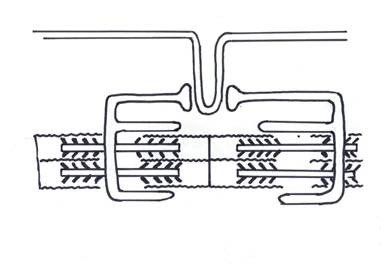
Рис. 11 Общая схема внутриклеточных структур, участвующих в электро-механическом сопряжении
1. Электрический сигнал в виде ПД проводится по мембране и распространяется вглубь клетки по системе поперечных Т-тубул, образующих с терминальными цистернами саркоплазматического ретикулума (СР) специализированные контакты.
2. Деполяризация, передающаяся с Т-тубул на СР приводит к выделению из терминальных цистерн значительного количества свободных ионов Са2+ . При этом концентрация свободного кальция в миоплазме и области миофибрилл увеличивается с 10-9М до 10-7М.
3. Ионы Са2+ связываются с тропонином, что приводит к конформационным изменениям тропомиозина и смещению его из ложбины между нитями актина. В результате этого смещения на молекулах тропонина открываются активационные места для взаимодействия и головками миозина (рис. 11).
4. Происходит связывание головок миозина с нитями актина, образование «поперечных мостиков» и проворачивание на некоторый угол головок актина относительно толстой нити. Это движение происходит за счет сокращения молекулярной пружины и освобождения потенциальной энергии, запасенной заранее в этой пружине. Благодаря такому кооперативному движению большого количества мостиков (напоминающему синхронный гребок многих весел на байдарке) осуществляется скольжение толстых нитей относительно тонких и сближение Z-нитей саркомера.
5. Расщепление АТФ миозиновой АТФазой. Для того чтобы сделать очередной «гребок», головки миозина должны выйти из зацепления с актином. Для отсоединения миозина необходима затрата энергии АТФ. Одновременно с отсоединением энергия АТФ затрачивается на «разгибание» молекулярной пружины, необходимое для захвата следующей молекулы актина. Все время пока тропонин находится в связанном с Са2+ состоянии, головки миозина способны совершать гребковые движения и обеспечивать сокращение саркомеров.
|
|
|
6. После завершения фазы реполяризации потенциала действия прекращается выделение Са2+ из СР и исчезает поток кальция к сократительным белкам. При этом за счет интенсивной работы Са-АТФазы, находящейся в мембране продольных трубочек СР, ионы кальция перемещаются из миоплазмы в просвет продольных трубочек. Концентрация Са2+ в миоплазме быстро снижается до 10-9М, что приводит к отщеплению кальция от тропонина, обратной конформации тропомиозина, блокированию взаимодействия миозина с актином и расслаблению мышцы.
При отсутствии в среде АТФ молекулы миозина могут взаимодействовать с нитями актина, но отсоединение уже невозможно. Это состояние называется “rigor mortis” (трупное окоченение).
|
|
|


