 |
Особенности строения циклоалканов.
|
|
|
|
В строении циклоалканов имеется ряд особенностей, определяющих их химическое поведение.
Малые циклы. Трёхчленный цикл неустойчив и способен легко разрываться; четырёхчленный цикл несколько более устойчив.
Циклопропан имеет плоское строение, поэтому атомы водорода у соседних атомов углерода располагаются над и под плоскостью в энергетически невыгодном, заслонённом положении (рис.2, а). Это является одной из причин неустойчивости цикла.
Исходя из того, что трёхчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60, т.е. резко отличающимися от величины нормального валентного угла 109,5. Чтобы избежать такого искажения валентных углов, в циклопропане образование -связей между атомами углерода происходит путём перекрывания sp 3-гибридных орбиталей не по прямой, соединяющей ядра атомов, а вне её.
Такое перекрывание не является осевым, характерным для образования -связей, а несколько приближается к боковому перекрыванию, характерному для образования -связи. Образовавшиеся -связи с расположением максимальной электронной плотности вне прямой между ядрами связываемых атомов называют «банановыми» (рис.2, б). По свойствам они напоминают -связи. Действительно, циклопропан способен вступать в реакции присоединения (с разрывом цикла).
Обычные циклы. Пяти-, шести- и семичленные циклы очень устойчивы и не склонны к разрыву в химических реакциях. Многие природные соединения содержат пяти- и шестичленные циклы. Циклогексановое кольцо входит в состав биологически активных и лекарственных веществ – терпеноидов, стероидов и др.
|
|
|
Молекула циклогексана не является плоским многоугольником, так как при плоском строении валентные углы между атомами углерода были бы равны 120, т. е. отклонялись бы от величины нормального валентного угла, и все атомы водорода находились бы в энергетически невыгодном, заслонённом положении. Эти обстоятельства привели бы к неустойчивости цикла. В действительности же шестичленный цикл является одним из самых устойчивых.
Молекула циклогексана принимает различные конформации за счёт частичного вращения вокруг -связей между атомами углерода. Среди нескольких неплоских конформаций наиболее энергетически выгодной является конформация кресла (рис.3, а), так как в ней все валентные углы между атомами углерода равны 109,5, а все атомы водорода у соседних атомов углерода находятся относительно друг друга в заторможенном положении.
Поскольку цикл неплоский, то не имеет смысла говорить о расположении двух связей каждого атома углерода с атомами водорода «над и под плоскостью». Каждый атом углерода циклогексана в конформации кресла имеет одну аксиальную (символ а) и одну экваториальную (символ е) связи с атомами водорода (рис.3, б). Шесть аксиальных С – Н связей попеременно направлены вверх и вниз. Шесть экваториальных С – Н связей направлены как бы в строну от цикла, и атомы водорода при этом находятся в наиболее удалённом друг от друга положении. Если в циклогексан вместо атома водорода введён какой-либо заместитель R, то наиболее выгодным будет его нахождение в экваториальном положении.
17.Ароматические углеводороды. Классификация, номенклатура и изомерия. Строение бензола, признаки ароматичности, правило Хюккеля.
Номенклатура.
Первым членом гомологического ряда ароматических углеводородов является бензол, который при составлении названий по заместительной номенклатуре принимается за родоначальную структуру. Заместители обозначаются в виде префиксов с указанием их местоположения в бензольном ядре. В ряду аренов сохранились и тривиальные названия (приведены ниже в скобках).
|
|
|
 Изомерия.
Изомерия.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещённые производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещённые производные существуют в виде трёх изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто (о-), мета (м-), пара (п-).
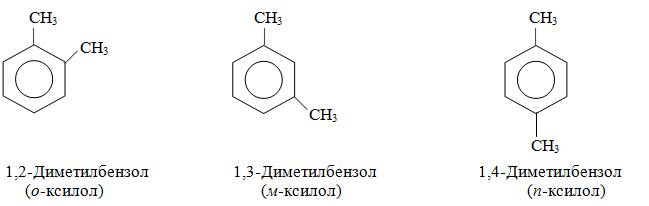 Радикалы ароматических углеводородов называют арильными радикалами, аналогично алкильным радикалам в случае алканов. Радикал бензола называется фенил С6Н5–, толуола –толил СН3С6Н4–
Радикалы ароматических углеводородов называют арильными радикалами, аналогично алкильным радикалам в случае алканов. Радикал бензола называется фенил С6Н5–, толуола –толил СН3С6Н4–
18.Арены. Реакции электрофильного замещения. Электронодонорные (I рода) и электроноанцепторные (II рода) заместители, их направляющие действия в реакциях SE.
I.Реакции электрофильного замещения в ароматическом ядре (SЕ).
Арены вступают в ионные реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE (от англ. substitution electrophilic). Реакция начинается с возникновения π – комплекса, из которого затем образуется -комплекс, и завершается стабилизацией -комплекса за счёт отщепления протона
Галогенирование.
Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов, которыми чаще всего являются безводные галогениды алюминия AlCl3, AlBr3 и железа FeCl3, FeBr3.
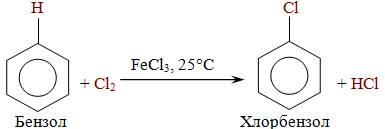
Эта реакция используется только для получения хлор- и бром- замещённых аренов. Реакция с фтором протекает слишком бурно, так как фтор очень активен и получить фторзамещённые продукты невозможно. Реакция иодирования аренов практически не осуществляется ввиду очень низкой активности йода.
Нитрование.
Бензол очень медленно реагирует с концентрированной азотной кислотой даже при нагревании. Однако при действии на него смеси концентрированных азотной и серной кислот, так называемой нитрующей смеси, легко происходит реакция нитрования, т. е. замещение водорода в ядре на нитрогруппу – NO2.
|
|
|

Атакующей электрофильной частицей в этой реакции является нитроил-катион NO2+, который образуется при взаимодействии азотной и серной кислот.
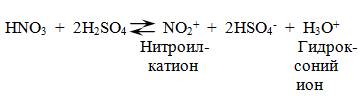
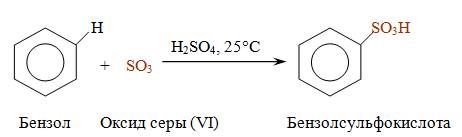
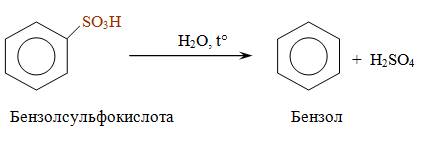
Сульфирование.
В результате этой реакции происходит замещение водорода в бензольном ядре на сульфогруппу – SO3H. Бензол взаимодействует с дымящей серной кислотой при комнатной температуре. Дымящей называется серная кислота, в которой растворён оксид серы (VI). Именно нейтральная молекула оксида серы (VI), или триоксида серы, является электрофильным реагентом.
В отличие от других реакций электрофильного замещения сульфирование аренов является обратимой реакцией. При нагревании с водой в кислой среде происходит обратная реакция –десульфирование с образованием исходного ароматического углеводорода.
Алкилирование.
В результате этой реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола – алкилбензолов. Эта реакция известна под названием алкилирования по Фриделю-Крафтсу (1877).
Алкилирование протекает при действии на ароматические углеводороды галогеналканов в присутствии катализаторов – галогенидов алюминия. С помощью катализатора происходит поляризация молекулы галогеналкана с образованием из неё электрофильной частицы.
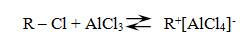
В зависимости от строения радикала в галогеналкане различают реакции метилирования, этилирования и т. д.
19.Реакции окисления, восстановления, боковой цепи. Применение бензола, толуола, фенантрена в синтезе лекарственных веществ.
II.Реакции окисления и восстановления.
Окисление.
Отличительной чертой ароматических углеводородов является их устойчивость к окислению. В обычных условиях на бензол не действуют такие сильные окислители как азотная кислота, хромовая смесь, перманганат калия. По устойчивости к действию окислителей арены сходны с алканами. Однако арены, как и алканы, могут подвергаться окислению в жёстких условиях в присутствии катализаторов.
Восстановление.
|
|
|
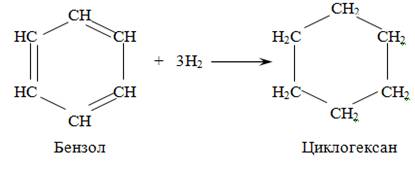
Реакция присоединения водорода к бензолу (гидрирование) идёт в жёстких условиях в присутствии металлических катализаторов (Ni, Pt, Pd). Молекула бензола присоединяет три молекулы водорода и превращается в циклогексан, а гомологи бензола – в производные циклогексана.
III.Реакции в боковой цепи.
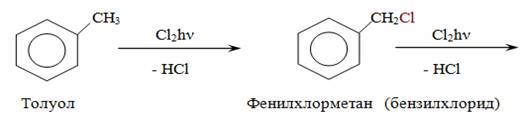
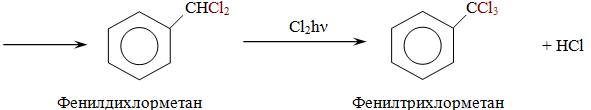
Галогенирование.
Гомологи бензола имеют ряд особенностей в химическом поведении, связанных с наличием в их молекулах алкильных радикалов. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген в условиях свободно-радикальной реакции замещения. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с ароматическим кольцом (у α-атома углерода).

|
|
|


